Rubottom-Oxidation
Die Rubottom-Oxidation (auch Rubottom-Reaktion genannt) ist eine Namensreaktion der Organischen Chemie, bei der ein Keton oder Aldehyd in das entsprechende α-Hydroxy-Keton bzw. -Aldehyd umgewandelt wird.[1][2]
Sie wurde 1974 von mehreren Forschergruppen unabhängig voneinander entdeckt und in der Literatur beschrieben: Die erste Veröffentlichung dieser Reaktion geht auf den kanadischen Chemiker Adrian G. Brook (1924–2013)[3] am 10. Juni zurück.[4] Danach wurde die Reaktion von einer Gruppe um den US-amerikanischen Chemiker Alfred Hassner (* 1930)[5] am 4. September beschrieben.[6] Am 24. September wurde die Reaktion schließlich von einer Gruppe um den US-amerikanischen Chemiker George M. Rubottom (* 1940)[7] eingereicht, nach dem die Reaktion letztendlich benannt wurde.[8]
Übersichtsreaktion
Bei der Rubottom-Reaktion wird ein Keton bzw. Aldehyd an dem α-Kohlenstoff-Atom mit meta-Chlorperbenzoesäure (m-CPBA) zur entsprechenden α-Hydroxy-Verbindung oxidiert. Beispielhaft ist die Reaktion für Aceton dargestellt:
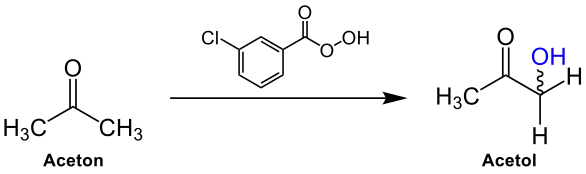
Reaktionsmechanismus
Am Beispiel von Aceton wird ein möglicher Reaktionsmechanismus vorgestellt.
Im ersten Schritt erfolgt die Herstellung eines Silylenolethers (2) durch Reaktion von Aceton (1) mit Triethylsilyltriflat und Triethylamin (Variante (a)) oder mit Lithiumdiisopropylamid (LDA) und Chlor(trimethyl)silan (TMS-Cl) (Variante (b)):[2]
- Bei Variante (a) reagiert Aceton (1) zunächst mit dem harten Elektrophil Triethylsilyltriflat am Carbonyl-Sauerstoff-Atom zum Kation (1a), welches anschließend durch die schwache Base Triethylamin deprotoniert wird, sodass sich der Silylenolether (2) bildet.[9]
- Bei Variante (b) ist der Reaktionsweg etwas anders: Hier reagiert Aceton (1) mit LDA zu dem Lithiumenolat (1b), welches mit TMSCl zum Silylenolether (2) reagiert.[9]

Im zweiten Schritt wird aus dem Silylenolether schließlich die entsprechende α-Hydroxy-Verbindung gebildet. Dabei kommt es unter Zugabe von z. B. m-CPBA zum Enol (2) zur Epoxidation, sodass das Siloxyepoxid (3) entsteht. Der Epoxidring öffnet sich unter sauren Bedingungen und es bildet sich ein Carbokation (4), welches durch anomere Effekte stabilisiert ist. Durch die Brook-Umlagerung (1,4-Silyl-Wanderung) entsteht das α-Siloxy-Keton (5), bei der nur noch die Silyl-Gruppe entfernt werden muss, um die gewünschte α-Hydroxy-Verbindung (6) zu erhalten. Dies kann durch Zugabe von Tetrabutylammoniumfluorid (TBAF) und anschließender saurer Aufbereitung erfolgen. Da hierbei nur das Fluorid-Ion von TBAF an der Reaktion beteiligt ist, wird auch nur dieses in der Abbildung zum Reaktionsmechanismus aufgeführt.[2][1][10]

Atomökonomie
Die Rubottom-Oxidation hat sich als Methode etabliert, um α-Hydroxy-Carbonylverbindungen herzustellen, ist aber von ihrer Atomökonomie her nicht unbedingt empfehlenswert. Zum einen werden nämlich stöchiometrische Mengen an einem Trialkylsilylhalogenid, einer Base sowie von m-CPBA verwendet und zum anderen fallen große Mengen Abfall an. Vor allem aus letzterem Grund wird nach Alternativen gesucht, um α-Hydroxy-Carbonylverbindungen herzustellen. Dazu gehören z. B. der Einsatz von Dimethyldioxiran (DMDO) oder Sauerstoff aus der Luft als Oxidationsmittel.[11]
Anwendungsbeispiele
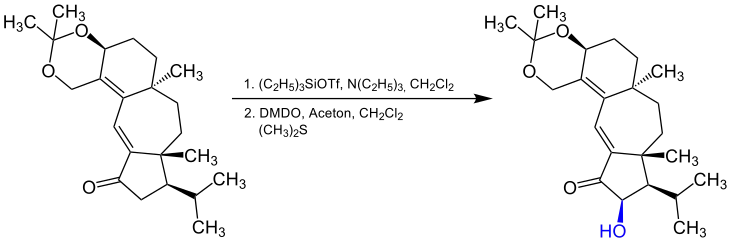
Es ist möglich die α-Hydroxylierung unter bestimmten Bedingungen enantioselektiv durchzuführen. Ein Beispiel dafür ist die Synthese von Guanakastepen A, die auf den US-amerikanischen Chemiker Samuel Danishefsky (* 1963) und Kollegen zurückgeht. Bei dieser Reaktion wird ebenfalls deutlich, dass sich die Rubottom-Oxidation mit DMDO durchführen lässt:[12]
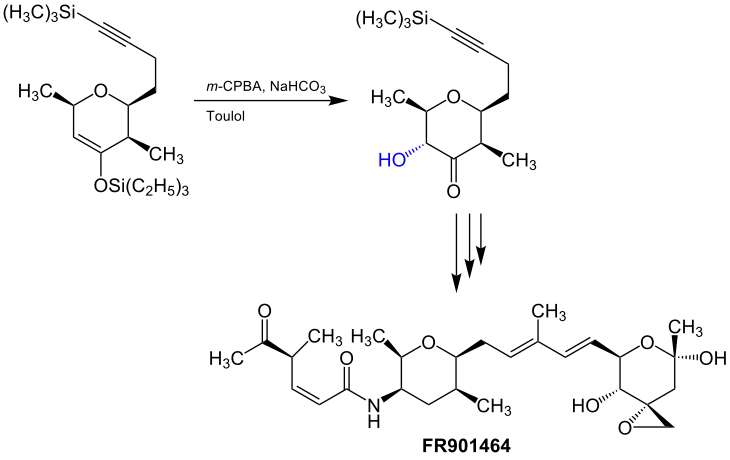
Ein weiteres Beispiel für die Anwendung der Rubottom-Oxidation lässt sich in der Synthese von FR901464, einer chemischen Verbindung, die gegen Tumoren wirkt, finden. Diese Synthese geht auf eine Gruppe um den US-amerikanischen Chemiker Eric N. Jacobsen (* 1960) zurück. In der Herstellung der Substanz, ist die Rubottom-Oxidation ein Teilschritt, um eine wichtige Teilverbindung von FR901464 zu synthetisieren. Ein Silylenolether durchläuft hierbei unter modifizierten Bedingungen die Rubottom-Reaktion (Puffer und unpolares Lösungsmittel).[1][13]
Einzelnachweise
- L. Kürti, B. Czakó: Strategic Applications of Named Reactions in Organic Synthesis. Elsevier Academic Press, Burlington/ San Diego/ London 2005, ISBN 0-12-369483-3, S. 388–389.
- Z. Wang: Comprehensive Organic Name Reactions and Reagents. Volume 3, John Wiley & Sons, Hoboken 2009, ISBN 978-0-471-70450-8, S. 2442–2445.
- Nachruf Adrian Brook. In: Toronto Star. abgerufen am 27. Juli 2017.
- G. M. Brook, D. M. Macrae: 1,4-Silyl rearrangements of siloxyalkenes to siloxyketones during peroxidation. In: Journal of Organometallic Chemistry. Band 77, Nr. 2, 1974, S. C19–C21,doi:10.1016/S0022-328X(00)81332-7.
- Jaques Cattell Press (Hrsg.): American Men & Women of Science. Band 3: G–I. 16. Auflage. R. R. Bowker Company, New York 1986, ISBN 0-8352-2224-1, S. 555.
- A. Hassner, R. H. Reuss, H. W. Pinnick: Synthetic methods. VIII. Hydroxylation of carbonyl compounds via silyl enol ethers. In: The Journal of Organic Chemistry. Band 40, Nr. 23, 1975, S. 3427–3429, doi:10.1021/jo00911a027.
- Jaques Cattell Press (Hrsg.): American Men & Women of Science. Band 6: Q–S. 16. Auflage. R. R. Bowker Company, New York 1986, ISBN 0-8352-2228-4, S. 345.
- G. M. Rubottom, M. A. Vazquez, D. R. Pelegrina: Peracid oxidation of trimethylsilyl enol ethers: A facile α-hydroxylation procedure. In: Tetrahedron Letters. Band 15, Nr. 49–50, 1974, S. 4319–4322, doi:10.1016/S0040-4039(01)92153-7.
- J. Clayden, N. Greeves, S. Warren: Organic Chemistry. 2. Auflage. Oxford University Press, New York 2012, ISBN 978-0-19-927029-3, S. 466.
- J. Clayden, N. Greeves, S. Warren: Organic Chemistry. 2. Auflage. Oxford University Press, New York 2012, ISBN 978-0-19-927029-3, S. 550.
- J. Christoffers, A. Baro, T. Werner: α-Hydroxylation of β-Dicarbonyl Compounds. In: Advanced Synthesis & Catalysis. Band 346, Nr. 2–3, 2004, S. 143–151, doi:10.1002/adsc.200303140.
- M. Mandal, H. Yun, G. B. Dudley, S. Lin, D. S. Tan, S. J. Danishefsky: Total Synthesis of Guanacastepene A: A Route to Enantiomeric Control. In: The Journal of Organic Chemistry. Band 70, Nr. 26, 2005, S. 10619–10637, doi:10.1021/jo051470k.
- C. F. Thompson, T. F. Jamison, E. N. Jacobsen: Total Synthesis of FR901464. Convergent Assembly of Chiral Components Prepared by Asymmetric Catalysis. In: Journal of the American Chemical Society. Band 122, Nr. 42, 2000, S. 10482–10483, doi:10.1021/ja0055357.