Silyl-Schutzgruppe
Unter der Bezeichnung Silyl-Schutzgruppe fasst man eine ganze Reihe von chemischen Verbindungen zusammen, die dazu dienen können, eine reaktive funktionelle Gruppe durch eine Silicium-organische Verbindung in eine unreaktive Form zu überführen und damit einer unerwünschten Reaktion zu entziehen, also zu schützen. In der Regel werden Silylreste als Schutzgruppe der Hydroxy-Gruppe in Alkoholen oder Phenolen verwendet.
Verwendung
Hydroxygruppen in Alkoholen sind nukleophile funktionelle Gruppen und werden daher von Elektrophilen angegriffen oder in einer Eliminierungsreaktion entfernt. Um dies in unerwünschten Fällen zu verhindern, wurde die Schutzgruppentechnik in der organischen Chemie eingeführt. Durch eine Silylschutzgruppe wird der Alkohol mit der Hydroxygruppe zu einem relativ stabilen und unreaktiven Derivat des Alkohols, zu einem Silylether, in dem das Proton der Hydroxygruppe durch einen substituierten Siliciumrest ersetzt ist.
Durch eine Silylgruppe geschützte Hydroxy-Gruppen können direkt ohne einen vorherigen Entschützungsschritt zu Aldehyden,[1] Ketonen,[2] Bromiden,[3][4] Acetaten[5] und Ethern[6] umgesetzt werden.
Darstellung
Silylether werden meist durch Umsetzung der entsprechenden Silylchloride oder Silylsulfate mit Alkoholen oder Phenolen in Gegenwart von Basen hergestellt. Als Base kommen hier wenig nukleophile Basen wie Triethylamin oder die Diisopropylethylamin (Hünig-Base) zum Einsatz. Üblicherweise wird in trockenen und aprotischen organischen Lösungsmitteln wie Dichlormethan gearbeitet. Zu den Silylethern gibt es umfangreiche Untersuchungen über ihre Stabilität. Sie werden auch im erheblichen Umfang eingesetzt.
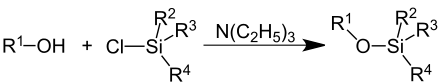
Das einfachste und preiswerteste Silan, das man als Reagenz zur Einführung der Silyl-Schutzgruppe kennt, ist das Trimethylchlorsilan (Mitte in obiger Abbildung, R2 = R3 = R4 = CH3). Es entsteht bei der Silikon-Herstellung nach Rochow und Müller als Nebenprodukt. Die höheren Silylhalogenide werden gezielt für den Einsatz als Schutzgruppe synthetisiert. Bedeutende Vertreter sind neben der Trimethylsilyl-Gruppe die höher substituierten Silane wie z. B. tert-Butyldimethylsilyl- und Triethylsilyl-Gruppen.
Stabilität
Mit steigender sterischer Hinderung am Silicium-Atom steigt auch die Stabilität der Schutzgruppe. Die Trimethylsilyl-Gruppe ist oft sehr labil und wird schon durch Kieselgel bei der Chromatographie teilweise gespalten. Die höheren Silylether sind jedoch gegenüber den Bedingungen einer Chromatographie stabil. Silylschutzgruppen können durch Säuren oder besser und selektiver durch Fluorid-Ionen gespalten werden. Als Fluorid-Quelle kann sowohl Kaliumfluorid, Tetrabutylammoniumfluorid (TBAF) aber auch Fluorwasserstoffsäure dienen.
V1.svg.png.webp)
Silyl-Gruppen sind die einzigen Schutzgruppen, welche durch Fluoridionen gespalten werden. Diese einzigartige Eigenschaft führt dazu, dass Silylschutzgruppen sehr selektiv neben allen anderen möglichen Schutzgruppen gespalten werden können.
V1.svg.png.webp)
| Name | Formel | Abkürzung | Spaltung |
|---|---|---|---|
| Trimethylsilyl | 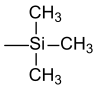 | TMS | Kaliumfluorid, Essigsäure oder Kaliumcarbonat in Methanol[7] |
| Triethylsilyl | 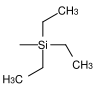 | TES | 10 bis 100-mal stabiler als eine TMS-Gruppe;[8] Trifluoressigsäure in Wasser/Tetrahydrofuran,[9] Essigsäure in Wasser/Tetrahydrofuran,[10] Fluorwasserstoffsäure, Pyridiniumhydrofluorid in Pyridin[11] |
| tert.-Butyldimethylsilyl | 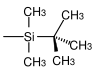 | TBS, TBDMS | Essigsäure in Tetrahydrofuran/Wasser,[12] Pyridiniumtosylat in Methanol,[13] Trifluoressigsäure in Wasser,[14] Fluorwasserstoffsäure in Acetonitril,[15] Pyridiniumhydrofluorid in Tetrahydrofuran,[16] Tetrabutylammoniumfluorid in THF[17] |
| Triisopropylsilyl | 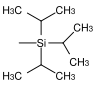 | TIPS | Unter gleichen Bedingungen wie TBS aber längere Reaktionszeiten; Tetrabutylammoniumfluorid in Tetrahydrofuran, Fluorwasserstoffsäure in Acetonitril, Pyridiniumhydrofluorid in Tetrahydrofuran.[18] |
| tert.-Butyldiphenylsilyl | 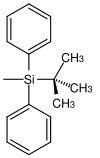 | TBDPS | Unter gleichen Bedingungen wie TBS aber längere Reaktionszeiten (100 bis 250-mal langsamer als TBS und 5 bis 10-mal langsamer als TIPS); Tetrabutylammoniumfluorid in Tetrahydrofuran, Fluorwasserstoffsäure in Acetonitril, Pyridiniumhydrofluorid in Tetrahydrofuran[19] |
Literatur
- Philip J. Kocieński: Protecting Groups, 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, ISBN 3-13-135601-4.
- Peter G.M. Wuts, Theodora W. Greene: Greene's Protective Groups in Organic Synthesis, 4. Auflage, John Wiley & Sons Inc., Hoboken, New Jersey, ISBN 0-471-69754-0.
- Eintrag zu Silyl-Schutzgruppen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. April 2014.
- Michael Schelhaas, Herbert Waldmann: „Schutzgruppenstrategien in der organischen Synthese“, in: Angewandte Chemie, 1996, 103, S. 2192–2219; doi:10.1002/ange.19961081805.
- Krzysztof Jarowicki, Philip Kocienski: „Protecting groups“, in: J. Chem. Soc., Perkin Trans. 1, 1998, S. 4005–4037; doi:10.1039/A803688H.
Einzelnachweise
- G.A. Tolstikov, M.S. Miftakhov, N.S. Vostrikov, N.G. Komissarova, M.E. Adler, O. Kuznetsov: Zh. Org. Khim. 1988, 24, 224–225.
- F. P. Cossio, J. M. Aizpurua, C. Palomo: Synthetic applications of chromium(VI) reagents in combination with chlorotrimethylsilane. In: Canadian Journal of Chemistry. 64 (2), 1986, S. 225–231, doi:10.1139/v86-039.
- S. Kim, J.H. Park: J. Org. Chem. 1988, 53, 3111–3113.
- J.M. Aizpurua,F.P. Cossio, C. Palomo: J. Org. Chem. 1986, 51, 4941–4943.
- S.J. Danishefsky, N.J. Mantlo: J. Am. Chem. Soc. 1988, 110, 8129–8133.
- D.G. Saunders: Synthesis, 1988, 377–378.
- P.J. Kocieński: Protecting Groups, S. 29.
- P.J. Kocieński: Protecting Groups, S. 31.
- Tod K Jones, Robert A. Reamer, Richard Desmond, Sander G. Mills: „Chemistry of tricarbonyl hemiketals and application of Evans technology to the total synthesis of the immunosuppressant (−)-FK-506“, in: J. Am. Chem. Soc., 1990, 112, S. 2998–3017; doi:10.1021/ja00164a023.
- Dieter Seebach, Hak-Fun Chow, Richard F.W. Jackson, Marius A. Sutter, Suvit Thaisrivongs, Jürg Zimmermann: „(+)-11,11′-Di-O-methylelaiophylidene – preparation from elaiophylin and total synthesis from (R)-3-hydroxybutyrate and (S)-malate“, in: Liebigs Ann. Chem., 1986, S. 1281–1308; doi:10.1002/jlac.198619860714.
- David A. Evans, Stephen W. Kaldor, Todd K. Jones, Jon Clardy, Thomas J. Stout: „Total synthesis of the macrolide antibiotic cytovaricin“, in: J. Am. Chem. Soc., 1990, 112, S. 7001–7031; doi:10.1021/ja00175a038.
- James A. Marshall, Richard Sedrani: „A convergent, highly stereoselective synthesis of a C-11-C-21 subunit of the macbecins“, in: J. Org. Chem., 1991, 56, S. 5496–5498; doi:10.1021/jo00019a004.
- James D. White, Motoji Kawasaki: „Total synthesis of (+)-Latrunculin A“, in: J. Am. Chem. Soc., 1990, 112, S. 4991–4993; doi:10.1021/ja00168a071.
- Morris J. Robins, Vicente Samano, Mark D. Johnson: „Nucleic acid-related compounds. 58. Periodinane oxidation, selective primary deprotection, and remarkably stereoselective reduction of tert-butyldimethylsilyl-protected ribonucleosides. Synthesis of 9-(β-D-xylofuranosyl)adenine or 3'-deuterioadenosine from adenosine“, in: J. Org. Chem., 1990, 55, S. 410–412; doi:10.1021/jo00289a004.
- R. Roger F. Newton, Derek P. Reynolds, Colin F. Webb, Stanley M. Roberts: „A short and efficient total synthesis of (±) prostaglandin D2 methyl ester involving a new method for the cleavage of a dimethyl-t-butylsilyl ether“, in: J. Chem. Soc., Perkin Trans. 1, 1981, S. 2055–2058; doi:10.1039/P19810002055.
- Kyriacos C. Nicolaou, R. A. Daines, T. K. Chakraborty: „Total synthesis of amphoteronolide B“, in: J. Am. Chem. Soc., 1987, 109, S. 2208–2210; doi:10.1021/ja00241a063.
- Leo A. Paquette, Annette M. Doherty, Christopher M. Rayner: „Total synthesis of furanocembranolides. 1. Stereocontrolled preparation of key heterocyclic building blocks and assembly of a complete seco-pseudopterane framework“, in: J. Am. Chem. Soc., 1991, 109, S. 3910–3926; doi:10.1021/ja00036a045.
- P.J. Kocieński: Protecting Groups, S. 40.
- P.J. Kocieński: Protecting Groups, S. 38–39.