Robinson-Schöpf-Reaktion
Die Robinson-Schöpf-Reaktion (auch Robinson-Schöpf-Kondensation, Robinson-Synthese oder Robinson-Tropinon-Synthese genannt) ist eine Namensreaktion der Organischen Chemie. Sie zählt zu den Multikomponentenreaktionen und dient der Synthese von Tropinon. Ihr Name geht auf den britischen Chemiker Robert Robinson (1886–1975) und den deutschen Chemiker Clemens J. Schöpf (1899–1970) zurück. 1917 wurde die Reaktion erstmals von Robinson in der Literatur beschrieben und 1935 von Schöpf verbessert.[1][2][3][4] Dem deutschen Chemiker gelang es hierbei die Synthese unter physiologischen Bedingungen (pH = 5–9) ablaufen zu lassen und die Ausbeute in diesem Zuge deutlich zu steigern.[4][5]

Übersichtsreaktion
Ursprünglich wurde die Reaktion von Methylamin, Succinaldehyd und Acetondicarbonsäure zu Tropinon als Robinson-Schöpf-Reaktion bezeichnet. An diesem Beispiel wird die Reaktion dargestellt:[1]
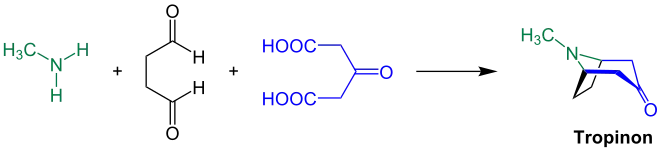
Es ist möglich auch anstelle von Succinaldehyd andere Aldehyde (außer Formaldehyd) einzusetzen, wodurch weitere Tropan-Alkaloide erhalten werden können.[6] Darauf wird im Abschnitt Anwendungsbeispiele näher eingegangen.
Reaktionsmechanismus
Wie oben bereits beschrieben, soll ein möglicher Reaktionsmechanismus am Beispiel der Synthese von Tropinon vorgestellt werden.[1]
Formal gesehen, lässt sich der Mechanismus der Robinson-Schöpf-Reaktion als doppelte Mannich-Reaktion beschreiben. In den ersten Schritten kommt es zu einer intermolekularen Mannich-Reaktion. Dabei wird der Succinaldehyd (1) nucleophil von Methylamin (2) angegriffen, wobei es unter Wasserabspaltung zur Bildung des Imins kommt (3). Durch einen intramolekularen nucleophilen Angriff kommt es durch einen Ringschluss zur Ausbildung des cyclischen Zwitterions (4). Durch dieses cyclische Zwitterion wird die Diacetoncarbonsäure (5) deprotoniert, sodass sich die Enolat-Form der Säure bildet (5a). Im nächsten Schritt erfolgt die Addition des Enolats (5a) an das cyclische Iminiumion (4a), wodurch die erste Mannich-Reaktion mit dem Zwischenprodukt (6) abgeschlossen ist.

Das Zwischenprodukt (6) kann auf verschiedene Arten graphisch dargestellt werden, wobei alle Arten das gleiche Molekül zeigen. Der zweite Teil des Reaktionsmechanismus wird mit Variante (iii) erklärt:
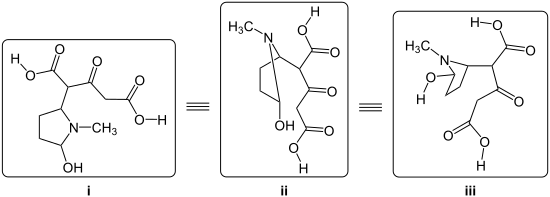
Im zweiten Teil des Reaktionsmechanismus kommt es mit dem Zwischenprodukt (6) direkt zur zweiten Mannich-Reaktion, die intramolekular abläuft. Auch hierbei bildet sich unter Wasserabspaltung ein Zwitterion (7). Nach Ausbildung der Enol-Form, kommt es erneut zu einem Ringschluss, sodass die bicyclische Grundstruktur (8) geschaffen ist. Durch doppelte β-Decarboxylierung bildet sich das Endprodukt, Tropinon (9):[1]

.
Atomökonomie
Eine chemische Reaktion hat eine sehr gute Atomökonomie, wenn aus den Edukten nur das gewünschte Hauptprodukt gebildet wird und keine unerwünschten Nebenprodukte auftreten. Es entsteht also kein Abfall.[7] Betrachtet man den Reaktionsmechanismus der Robinson-Schöpf-Reaktion, wird deutlich, dass in der Synthese von Tropinon je zwei Äquivalente Wasser und Kohlenstoffdioxid abgespalten werden und somit als Abfall anfallen. Die Atomökonomie kann daher also eher als mittelmäßig eingestuft werden, sodass diese Namensreaktion unter diesem Gesichtspunkt nicht sehr effizient abläuft.
Anwendungsbeispiele
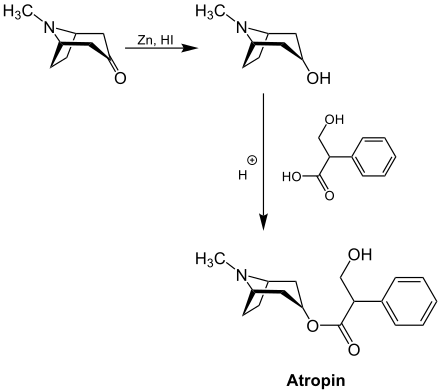
Die Robinson-Schöpf-Reaktion wird eingesetzt, um Tropan-Alkaloide synthetisch herzustellen. Grundsätzlich ist es möglich, durch die klassische Robinson-Schöpf-Reaktion zunächst Tropinon herzustellen und davon ausgehend z. B. Atropin herzustellen. Dafür erfolgt zunächst eine Reduktion der Carbonylgruppe des Tropinons zu einer Hydroxygruppe. Es bildet sich also ein Alkohol, der anschließend mit Tropasäure verestert wird.[8]
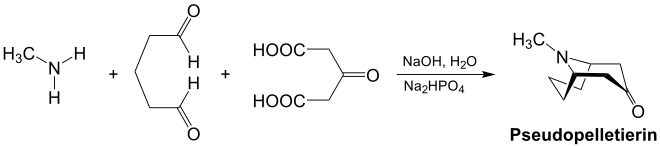
In der klassischen Robinson-Schöpf-Reaktion wird Succinaldehyd eingesetzt, nutzt man andere Aldehyde, lassen sich weitere Alkaloide herstellen. Ein Beispiel dafür ist die Synthese von Pseudopelletierin aus Methylamin, Glutaraldehyd und Acetondicarbonsäure, die von einer Gruppe um den US-amerikanischen Chemiker Arthur C. Cope (1909–1966) entwickelt wurde:[9]
Einzelnachweise
- Z. Wang: Comprehensive Organic Name Reactions and Reagents. Volume 3, John Wiley & Sons, Hoboken 2009, ISBN 978-0-471-70450-8, S. 2414–2417.
- R. Robinson: LXIII. – A Synthesis of Tropinone. In: Journal of the Chemical Society. Band 111, 1917, S. 762–768, doi:10.1039/CT9171100762.
- R. Robinson: LXXV.-A Theory of the Mechanism of the Phytochemical Synthesis of certain Alkaloids. In: Journal of the Chemical Society. Band 111, 1917, S. 876–899, doi:10.1039/ct9171100876.
- C. Schöpf, G. Lehmann: Die Synthese des Tropinons, Pseudopelletierins, Lobelanins und verwandter Alkaloide unter physiologischen Bedingungen. In: Justus Liebigs Annalen der Chemie. Band 518, Nr. 1, 1935, S. 1–37, doi:10.1002/jlac.19355180102.
- C. Schöpf: Die Synthese von Naturstoffen, insbesondere von Alkaloiden, unter physiologischen Bedingungen und ihre Bedeutung für die Frage der Entstehung einiger pflanzlicher Naturstoffe in der Zelle. In: Angewandte Chemie. Band 50, Nr. 40, 1937, S. 779–787, doi:10.1002/ange.19370504002.
- L. A. Paquette, J. H. Heimaster: The Stereochemical Course of a Robinson-Schöpf Biogenetic-Type Reaction. The Conformation of Certain Tricyclic Tropane Congeners. In: Journal of the American Chemical Society. Band 88, Nr. 4, 1966, S. 763–768, doi:10.1021/ja00956a029.
- B. M. Trost: On Inventing Reactions for Atom Economy. In: Accounts of Chemical Research. Band 35, Nr. 9, 2001, S. 695–705, doi:10.1021/ar010068z.
- R. O. C. Norman: Principles of Organic Synthesis. 2. Auflage. Chapman & Hall Ltd., London 1978, S. 280.
- A. C. Cope, H. L. Dryden, C. F. Howell: Pseudopelletierine. In: Organic Syntheses. Band 37, 1957, S. 73, doi:10.15227/orgsyn.037.0073.