Rieke-Metalle
Rieke-Metalle sind eine Gruppe speziell aufbereiteter, hochreaktiver Metallpulver. Diese liegen meist als feinzerstäubte Suspension in Tetrahydrofuran vor. Dadurch bildet sich zum Einen keine Oxid-Schicht an der Oberfläche und es steht – bei gleicher Menge verglichen mit einem Metallstück – mehr Oberfläche zur Verfügung.[1] Die Herstellungsmethoden wurden von Reuben D. Rieke entwickelt, welcher sich 40 Jahre mit der Erforschung und Herstellung zinkorganischer Verbindungen und Grignard-Verbindungen beschäftigt hat.[2] Dabei werden die aktiven Metalle durch Reduktion entsprechender Metallsalze in Tetrahydrofuran frisch vor der Reaktion in situ angesetzt und nicht vom entstehenden Salz (z. B. Kaliumchlorid) abgetrennt. Meist dienen als Reduktionsmittel Kalium oder Lithium in Verbindung mit einem Elektronenüberträger. Sie ermöglichen die Darstellung von nur schwer herstellbaren Organometallverbindungen bereits unter milden Bedingungen.[3][4][5][6][7]
Rieke-Magnesium
Darstellung
Die Darstellung von Rieke-Magnesium (Mg*) erfolgt aus Magnesiumchlorid, indem Kalium und Kaliumiodid zugegeben werden. Die Bedingungen sind in der Literatur beschrieben.[3]
Reaktionen
Rieke-Magnesium eignet sich besonders gut für die Herstellung von Grignard-Verbindungen.[7] Ein Beispiel hierfür ist die Reaktion des halogenierten Benzols zur Organometallverbindung 1:[6]
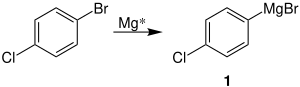
1 kann dann beispielsweise unter Zugabe von Benzaldehyd in einer Grignard-Reaktion zum Alkohol 2 weiterreagieren:[6]
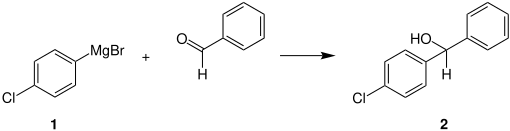
Rieke-Zink
Herstellung
Durch Reduktion von Zinkchlorid mittels Kalium lässt sich Rieke-Zink (Zn*) gewinnen. Genauere Bedingungen sind in der Literatur beschrieben.[6]
Reaktionen
Rieke-Zink bildet bereits bei Raumtemperatur mit verschiedenen sekundären oder tertiären Verbindungen, unter anderem also mit halogenierten Heterocyclen – wie etwa dem 2-Iodothiophen – Metallorganoverbindungen aus:[6]
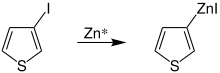
Diese zinkorganischen Verbindungen ermöglichen zum Beispiel die Substitution von Organylresten (z. B. Arylreste) an das Thiophen, was vielfältige Möglichkeiten im Anwendungsgebiet der Polythiophene eröffnet. Ein Beispiel ist die Überführung einer zinkorganischen Verbindung des Thiophens zum 2-Phenylthiophen (1):[6]
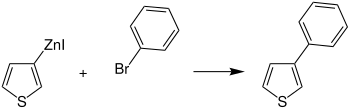
Rieke-Indium
Herstellung
Die Darstellung von Rieke-Indium (In*) erfolgt mittels Kalium im Rahmen der Reduktion von Indiumchlorid:[6]
Reaktionen
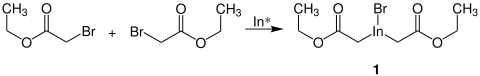
Rieke-Indium ist in der Lage, zwei bromierte Ester zu binden und so die metallorganische Verbindung 1 auszubilden:[6]
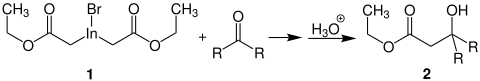
Derartige Reagenzien eignen sich insbesondere für eine Reformatzki-Reaktion. Durch die Reaktion eines Ketons mit 1 entstehen β-Hydroxyester wie 2:[6]
Rieke-Calcium
Herstellung
Die Darstellung von Rieke-Calcium (Ca*) kann durch Reduktion von Calciumbromid erfolgen. Als Reduktionsmittel fungiert Lithiumbiphenyl – ein Lithiumsalz des Biphenyl:[5]
Reaktionen
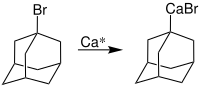
Rieke-Calcium eignet sich besonders gut für die Synthese von Organocalciumverbindungen.[6] So lässt sich zum Beispiel bromiertes Adamantan mit Ca* zur Reaktion bringen:[5][1]
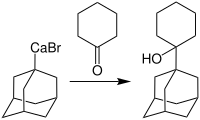
Derartige Reagenzien ermöglichen es, wichtige Adamantan-Derivate zu synthetisieren, welche in der Behandlung von Demenz vom Alzheimer-Typ eingesetzt werden. Als Anwendungsbeispiel ist hier die Synthese von 1-(1-Adamantyl)cyclohexanol gegeben:[5]
Rieke-Kupfer
Herstellung
Je nach Zielprodukt wird Rieke-Kupfer (Cu*) aus einem der drei Einlagerungssalze Kupfercyanid•Lithiumbromid, Kupferiodid•Tributylphosphan oder Kupferiodid•Triphenylphosphan (CuI•PPh3) hergestellt. Dabei dient Lithiumnaphthalen – ein Lithiumsalz des Naphthalin – als Reduktionsmittel:[6]
Reaktionen
Rieke-Kupfer bildet direkte Organokupferverbindungen mit Halogenkohlenwasserstoffen aus, wie etwa mit 2-(4-bromobutyl)oxiran:[6]
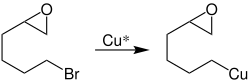
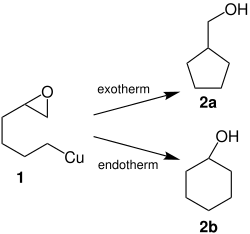
Diese Organometallverbindung (1) kann dann je nach Reaktionsbedingungen zum Cyclopentylmethanol (2a) oder Cyclohexanol (2b) umgesetzt werden:[6]
Rieke-Metalle und Polymere
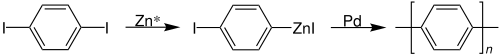
Rieke-Metalle können auch für regioselektive Polymerisationen eingesetzt werden. Ein Beispiel hierfür ist die durch Rieke-Zink (Zn*) ermöglichte Polymerisation von iodiertem Benzol über eine Organozinkverbindung zum Polybenzol:[6]
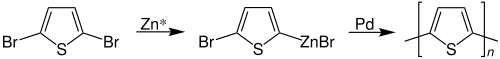
Ein weiteres für die Praxis hochrelevantes Beispiel ist die durch Rieke-Zink (Zn*) regioselektiv gesteuerte Polymerisation von bromiertem Thiophen zu Polythiophenen. Dieser Ablauf wird auch als Rieke-Methode bezeichnet:[6]
Einzelnachweise
- Tse-Chong Wu, Heping Xiong, Reuben D. Rieke: Organocalcium Chemistry: Preparation and Reactions of Highly Reactive Calcium. In: The Journal of Organic Chemistry. 55, Nr. 17, August 1990, S. 5045–5051. doi:10.1021/jo00304a016.
- Rieke Metals. Abgerufen am 9. August 2017.
- Reuben D. Rieke, S. E. Bales, P. M. Hudnall, T. P. Burns, G. S. Poindexter: Highly Reactive Magnesium for the Preparation of Grignard Reagents: 1-Norbornane Acid. In: Organic Syntheses. 59, 1979, S. 85. doi:10.15227/orgsyn.059.0085.
- Reuben D. Rieke: Preparation of Organometallic Compounds from Highly Reactive Metal Powders. In: Science. 246, Nr. 4935, Dezember 1989, S. 1260–1264. doi:10.1126/science.246.4935.1260.
- Reuben D. Rieke, Loretta I. Rieke, Tse-Chong Wu: Highly Reactive Calcium for the Preparation of Organocalcium Reagents: 1-Adamantyl Calcium Halides and Their Addition to Ketones: 1-(1-Adamantyl)cyclohexanol. In: Organic Syntheses. 72, 1995, S. 147. doi:10.15227/orgsyn.072.0147.
- Reuben D. Rieke, Mark V. Hanson: New Organometallic Reagents Using Highly Reactive Metals. In: Tetrahedron. 53, Nr. 6, 1997, S. 1925–1956. doi:10.1016/S0040-4020(96)01097-6.
- Jun-sik Lee, Raffet Velarde-Ortiz, Albert Guijarro, Joshua R. Wurst, Reuben D. Rieke: Low-Temperature Formation of Functionalized Grignard Reagents from Direct Oxidative Addition of Active Magnesium to Aryl Bromides. In: The Journal of Organic Chemistry. 65, 2000, S. 5428–5430. doi:10.1021/jo000413i.