Rhenium(III)-chlorid
Rhenium(III)-chlorid ist eine anorganische chemische Verbindung des Rheniums aus der Gruppe der Chloride. Es wurde 1932 von Wilhelm Biltz, Wilhelm Geilmann und Friedrich Wilhelm Wrigge entdeckt.[5]
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
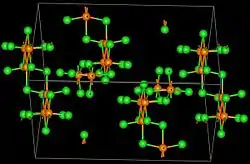 | |||||||||||||||||||
| _ Re3+ _ Cl− | |||||||||||||||||||
| Kristallsystem |
trigonal | ||||||||||||||||||
| Raumgruppe |
R3m | ||||||||||||||||||
| Gitterparameter |
a = 1033 pm, c = 2036 pm | ||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Rhenium(III)-chlorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Verhältnisformel | ReCl3 | ||||||||||||||||||
| Kurzbeschreibung |
dunkelroter Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 292,57 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
4,66 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sublimationspunkt |
450 °C[3] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Rhenium(III)-chlorid kann durch thermische Zersetzung von Rhenium(V)-chlorid gewonnen werden.[2]
Es kann weiterhin durch Umsetzung von Rhenium(V)-chlorid mit Zinn(II)-chlorid bei 250 °C hergestellt werden. Es entsteht mit hoher Ausbeute durch Reaktion von Re2(CH3CO2)4Cl2 mit trockenem Chlorwasserstoff bei 340 °C.[2]
Eigenschaften
Rhenium(III)-chlorid ist ein dunkelroter Feststoff. Er liegt in Form von dreikernigen diamagnetischen Re3Cl9 Clustern vor,[6] in dem zwei Doppelbindungen zwischen zwei Rhenium(III)-Ionen vorliegen.[2] An normal feuchter Luft einige Zeit beständig, in Wasser (Lösung anfänglich rot) und Basen erfolgt Hydrolyse. Es ist unter Bildung tiefroter Lösungen unzersetzt löslich in Aceton, Methanol und Ethanol, konzentrierter Salzsäure[4], Eisessig, Dimethylsulfon und Sulfolan (Tetrahydrothiophensulfon). In Salzsäure ist es löslich unter Bildung von [Re3Cl12]3− und ähnlichen Formen. Es reagiert mit Sauerstoff bei 400 °C zu Rheniumoxidchloriden, wird von Wasserstoff bei 250–300 °C zum Metall reduziert und zerfällt bei Temperaturen über 360 °C in Rhenium und Chlor. Der grüne Dampf enthält überwiegend Re3Cl9-Moleküle. Im festen Zustand besitzt es eine trigonale Kristallstruktur mit der Raumgruppe R3m (Raumgruppen-Nr. 160) und a = 1033 pm und c = 2036 pm. Die Kristallstruktur besteht aus Re3Cl9-Baueinheiten, die über je zwei Chlor-Brücken mit drei anderen Re3Cl9-Gruppen verknüpft sind.[2]
Einzelnachweise
- Datenblatt Rhenium(III) chloride bei Sigma-Aldrich, abgerufen am 25. Mai 2017 (PDF).
- Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1612.
- A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 2. Band: Nebengruppenelemente, Lanthanoide, Actinoide, Transactinoide. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049590-4, S. 1921 (Leseprobe: Teil C – Nebengruppenelemente. Google-Buchsuche).
- H. Gehrke, Jr. and D. Bue: Nonachlorotrirhenium(III). In: Robert W. Parry (Hrsg.): Inorganic Syntheses. Band 12. McGraw-Hill Book Company, Inc., 1970, ISBN 07-048517-8 (defekt), S. 193–196 (englisch).
- Wilhelm Biltz, Wilhelm Geilmann und Friedrich Wilhelm Wrigge, Rheniumtrichlorid (Memento des Originals vom 13. Januar 2017 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis., Nachrichten von der Gesellschaft der Wissenschaften zu Göttingen, 1932, S. 579–587
- Erwin Riedel, Christoph Janiak: Anorganische Chemie. Walter de Gruyter & Co KG, 2015, ISBN 978-3-11-038774-2 (books.google.de).
