Reissert-Indol-Synthese
Die Indolsynthese nach Arnold Reissert[1] (1860–1945) ist eine Namensreaktion der organischen Chemie, die ebenso wie bspw. die Fischersche Indolsynthese über mehrere Stufen verläuft.[2]
Übersichtsreaktion
Die Reissert-Indol-Synthese wird an der Reaktion von Nitrotoluolen und Oxalsäuredimethylester, der zu den Estern der Oxalsäure gehört, erklärt. Durch einen Ringschluss bildet sich bei dieser Reaktion ein Indol.
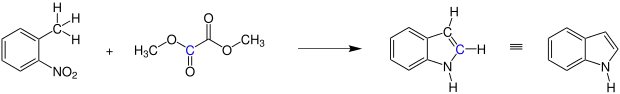
In der Übersichtsreaktion ist in blau das Kohlenstoffatom eingezeichnet, an dem der Ringschluss stattfindet.
Reaktionsmechanismus
Der Mechanismus der Reaktion wird am Beispiel der Reaktion von Nitrotoluolen mit Oxalsäuredimethylester zum Indol schrittweise erklärt:

In Nitrotoluolen (1) ist die Methylgruppe durch den elektropositiven Charakter der Nitrogruppe stark azidifiziert. Aus diesem Grunde kann in Anwesenheit starker Basen, in diesem Fall eines Methanolats, die Methylgruppe deprotoniert werden und so das Nitrotoluol zu einem Nucleophil 2, nämlich einem Carbanion, reagieren. Dieser Effekt kann über das Vinylogie-Prinzip erklärt werden, denn auch aliphatische Nitroverbindungen sind in deprotonierter Form als starke Nucleophile[3] bekannt (Vgl. Henry-Reaktion). Das Carbanion 2 greift den Oxalsäuremethylester (3) an, wodurch sich das Molekül 4 bildet. Durch die Abspaltung eines Methanolats bildet sich 2-Oxopropanoat 5. Dieses Molekül wird mit Zinn(II)-chlorid von einer Nitrogruppe zu einer Aminogruppe reduziert, so dass sich Molekül 6 bildet. Durch einen intermolekulern Ringschluss, wie er in Molekül 6 zu sehen ist, entsteht das Anion 7. Nach einer Protonenumlagerung vom Stickstoff zum Sauerstoff entsteht das Molekül 8. Unter dem nucleophilen Angriff eines Hydroxidions auf die Methylgruppe in Molekül 8 und Abspaltung von Wasser entsteht das Carboxylat 9, das wiederum protoniert wird. Das so erzeugte Indol-2-carbonsäure-Derivat 10 kann unter Hitzeeinwirkung decarboxyliert werden, wodurch sich das Indol (11) bildet; dieser letzte Schritt verläuft vollkommen analog zur klassischen Fischerschen Indolsynthese.[4]
Literatur
- K. P. C. Vollhardt, N. E. Schore: Organische Chemie. 4. Auflage. Wiley-VCH, Weinheim 2005, ISBN 978-3-527-31380-8.
Einzelnachweise
- A. Reissert: Einwirkung von Oxalester und Natriumäthylat auf Nitrotoluole. Synthese nitrirter Phenylbrenztraubensäuren. In: Berichte der deutschen chemischen Gesellschaft. Band 30, Nr. 1, 1897, S. 1030–1053, doi:10.1002/cber.189703001200.
- J. J. Li: Name Reactions in Heterocyclic Chemistry. John Wiley & Sons, 2004, ISBN 978-0-471-30215-5, S. 154.
- Reactivity Scales. (PDF; 61 kB) LMU München
- Z. Wang: Comprehensive Organic Name Reactions and Reagents, 3 Volume Set. John Wiley & Sons, Hoboken NJ 2009, ISBN 978-0-471-70450-8, S. 2341