Fischersche Indolsynthese
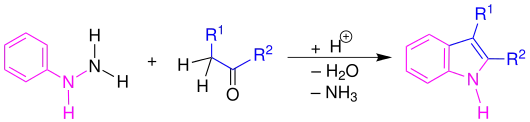
Die Fischersche Indolsynthese (auch Fischer-Indol-Synthese) ist eine Namensreaktion der Organischen Chemie, die zuerst 1883 von Emil Fischer beschrieben wurde.[1] Die Synthese dient zur Herstellung von Indolen. Dies geschieht durch das Erhitzen von Hydrazinen und Ketonen (oder Aldehyden) in Gegenwart eines sauren Katalysators:
Reaktionsmechanismus
Der Mechanismus, der zuerst von G. M. Robinson und R. Robinson beschrieben wurde, besteht aus mehreren Schritten. Im ersten Schritt reagiert Phenylhydrazin 1 mit einem Keton (bzw. Aldehyd). Dabei bildet sich das Phenylhydrazon 6 unter Wasserabspaltung. 6 und das Enamin 7 stehen in einem tautomeren Gleichgewicht. Es folgt darauf eine [3,3]-sigmatrope Umlagerung. Dieses bewirkt die Knüpfung einer C-C-Bindung unter Bildung der chinoiden Verbindung 8. Dann folgt die Rearomatisierung, wobei ein aromatisches Amin 9 entsteht. Nach einem internen, nucleophilen Angriff bildet sich ein Aminal 10. Nach der säurekatalytischen Abspaltung von Ammoniak und einer Deprotonierung, entsteht dann das gewünschte Indol 13.[2]
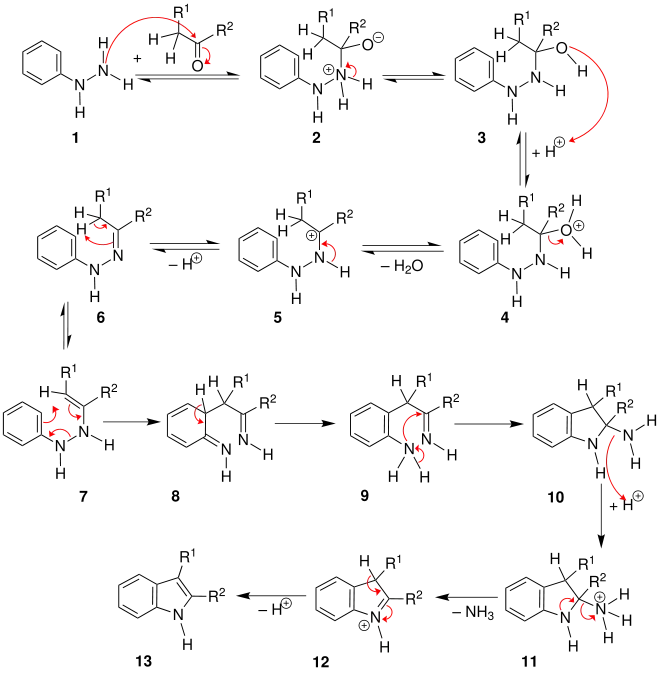
Literatur
- Emil Fischer, Friedrich Jourdan: Ueber die Hydrazine der Brenztraubensäure. In: Berichte der deutschen chemischen Gesellschaft. Band 16, Nr. 2, Juli 1883, S. 2241–2245, doi:10.1002/cber.188301602141 (Digitalisat auf Gallica).
- Gertrude Maud Robinson, Robert Robinson: A new synthesis of tetraphenylpyrrole. In: Journal of the Chemical Society, Transactions. Band 113, 1918, S. 639–645, doi:10.1039/CT9181300639.
- Theophil Eicher, Siegfried Hauptmann: The Chemistry of Heterocycles. 2nd, Wiley-VCH, Weinheim 2005, S. 106.
Weblinks
Einzelnachweise
- László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis; Elsevier Academic Press, Burlington-San Diego-London 2005, 1. Edition; ISBN 0-12-369483-3.
- J. Clayden, N. Greeves, S. Warren, P. Wothers: Organic Chemistry. Oxford University Press, 2001.