Phosphoglyceratkinase
Phosphoglyceratkinase (PGK) ist der Name für das Enzym, das dem Stoff 3-Phosphoglycerat eine Phosphat-Gruppe hinzufügt. Die umgekehrte Reaktion, das Entfernen von Phosphat von 1,3-Bisphosphoglycerat wird ebenso von PGK katalysiert und ist Teilschritt der Glykolyse, der Verwertung von Kohlenhydraten im Stoffwechsel aller Lebewesen. Mutationen im PGK-Gen können beim Menschen zu PGK-Mangel führen und zu hämolytischer Anämie.[1]
| Phosphoglyceratkinase | ||
|---|---|---|
| ||
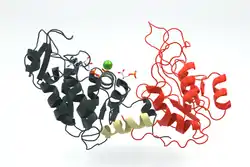
| Cartoondarstellung der PGK, mit ATP und PG (in Stick-Darstellung) und Magnesium Ion in grün. PDB 3PGK | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 416 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Monomer | |
| Bezeichner | ||
| Gen-Namen | PGK1 ; PGK2 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 2.7.2.3, Kinase | |
| Reaktionsart | (De-)Phosphorylierung | |
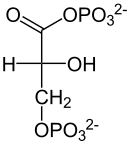
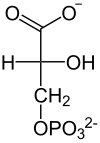
| Substrat | ATP + 3-Phospho-D-glycerat | |
| Produkte | ADP + 1,3-Biphospho-D-glycerat | |
| Vorkommen | ||
| Homologie-Familie | PGK | |
| Übergeordnetes Taxon | Lebewesen | |
Mit den Säugetieren hat sich eine zweite Isoform der PGK entwickelt (PGK2), die ausschließlich in den Hoden lokalisiert ist. Sie ist sehr wahrscheinlich durch Kopie des mRNA-Transkripts des PGK1-Gens mittels reverser Transkriptase entstanden, ein so genanntes Retrogen. PGK2 wird nur während der Spermatogenese exprimiert, als Ersatz für PGK1, deren Gen auf dem X-Chromosom lokalisiert ist, und deren Produktion daher in dieser Phase ruht.[2]
Die Bildung von PGK wird insbesondere von HIF-1 aktiviert. Eine weitere Funktion der PGK1 außerhalb der Glycolyse ist als Disulfid-Reduktase bei der Bildung von Blutgefäßen in Tumoren, wo sie durch CXCR4 aktiviert wird. PGK1 ist damit auch Teil der Signaltransduktion.[3][4]
Struktur
PGK ist in allen lebenden Organismen zu finden und seine Aminosäuresequenz wurde während der gesamten Evolution hoch konserviert. Das Enzym liegt als Monomer mit 415 Resten vor, das zwei nahezu gleich große Domänen enthält, die den N- und C-Termini des Proteins entsprechen.[5] 3-Phosphoglycerat (3-PG) bindet an den N-Terminus, während die Nukleotidsubstrate MgATP oder MgADP an die C-terminale Domäne des Enzyms binden. Diese erweiterte Zweidomänenstruktur ist mit großen Konformationsänderungen verbunden, die denen der Hexokinase ähneln.[6]
Die beiden Domänen des Proteins sind durch eine Spalte getrennt und durch zwei α-Helices verbunden.[7] Im Zentrum jeder Domäne befindet sich ein 6-strängiges, paralleles β-Faltblatt, die von α-Helices umgeben ist. Die beiden Lappen können unabhängig voneinander gefaltet werden, was auf das Vorhandensein von Intermediaten auf dem Faltungsweg mit einer einzigen gefalteten Domäne zurückzuführen ist.[8][9] Obwohl die Bindung beider Substrate eine Konformationsänderung auslöst, kommt es erst durch die Bindung beider Substrate zu einem domain closure (Verschluss des aktiven Zentrums mithilfe der Domänen), der zum Transfer der Phosphatgruppe führt.[7]
Das Enzym neigt dazu, in der offenen Konformation mit kurzen Zeiträumen des Verschlusses und der Katalyse zu existieren, was eine schnelle Diffusion von Substrat und Produkten durch die Bindungsstellen ermöglicht. Die offene Konformation von PGK ist aufgrund der Exposition einer hydrophoben Region des Proteins beim domain closure konformationsstabiler.[8]
Rolle des Magnesiums
Magnesiumionen sind normalerweise mit den Phosphatgruppen der Nukleotidsubstrate von PGK komplexiert. Es ist bekannt, dass in Abwesenheit von Magnesium keine Enzymaktivität auftritt.[10] Das zweiwertige Metall hilft den Enzymliganden dabei, die negativen Ladungen der gebundenen Phosphatgruppe abzuschirmen, wodurch der nucleophile Angriff erfolgen kann. Diese Ladungsstabilisierung ist ein typisches Merkmal der Phosphotransferreaktion.[11] Es wird vermutet, dass das Ion auch den domain closure fördert, wenn PGK beide Substrate gebunden hat.[10]
Katalysiertes Gleichgewicht
Phosphat wird von 1,3-Bisphosphoglycerat auf ADP übertragen und umgekehrt.
Mechanismus
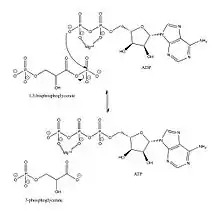
Ohne jede Substratbindung existiert PGK in einer „offenen“ Konformation. Nachdem sowohl das Triose- als auch das Nucleotidsubstrat an die N- und C-terminalen Domänen gebunden sind, tritt eine ausgedehnte Scharnierbewegung (hinge-bending motion) auf, welche die Domänen und ihre gebundenen Substrate in enge Nähe bringt und zu einer „geschlossenen“ Konformation führt.[12] Im Falle der vorwärtsgerichteten Glykolyse löst das β-Phosphat von ADP einen nucleophilen Angriff auf das Phosphat am C1-Atom von 1,3-BPG aus. Das Lys219 am Enzym führt die Phosphatgruppe zum Substrat.
PGK durchläuft einen ladungsstabilisierten Übergangszustand, der gegenüber der Anordnung des gebundenen Substrats im geschlossenen Enzym bevorzugt ist, da im Übergangszustand alle drei Phosphatsauerstoffatome durch Liganden stabilisiert sind, im Gegensatz zu nur zwei stabilisierten Sauerstoffatomen im gebundenen Anfangszustand.[13]
Regulierung
Das Enzym wird durch geringe Konzentrationen verschiedener mehrwertiger Anionen wie Pyrophosphat, Sulfat, Phosphat und Citrat aktiviert. Hohe Konzentrationen von MgATP und 3-PG aktivieren PGK, während Mg2+ in hohen Konzentrationen das Enzym nicht kompetitiv hemmt.[14]
PGK zeigt eine breite Spezifität gegenüber Nucleotidsubstraten.[15] Seine Aktivität wird durch Salicylate gehemmt, die das Nukleotidsubstrat des Enzyms zu imitieren scheinen.[16]
Es wurde gezeigt, dass macromolecular crowding (Überfüllung einer bspw. lebenden Zelle mit Makromolekülen) die PGK-Aktivität sowohl in Computersimulationen als auch in In-vitro-Umgebungen erhöht, die das Zellinnere simulieren. Infolge der Überfüllung wird das Enzym enzymatisch aktiver und kompakter.[5]
Klinische Bedeutung
PGK-Mangel ist ein X-chromosomal-rezessives Merkmal, das mit hämolytischer Anämie, psychischen Störungen und Myopathie beim Menschen assoziiert ist.[17][18] Je nach Form gibt es eine hämolytische und eine myopathische Form des PGK-Mangels.[19] Da das Merkmal X-chromosomal gebunden ist, wird es normalerweise bei Männern mit einem X-Chromosom vollständig exprimiert. Betroffene Frauen sind in der Regel asymptomatisch (ohne Symptome).[7][18] Der Zustand resultiert aus Mutationen in Pgk1, dem für PGK1 codierenden Gen, und es wurden zwanzig Mutationen identifiziert.[18][7] Auf molekularer Ebene beeinträchtigt die Mutation in Pgk1 die thermische Stabilität und hemmt die katalytische Aktivität des Enzyms.[7] PGK ist das einzige Enzym in der Glykolyse, das von einem X-chromosomalen Gen kodiert wird. Bei einer hämolytischen Anämie tritt ein PGK-Mangel in den Erythrozyten auf. Derzeit gibt es keine endgültige Behandlung für einen PGK-Mangel.[20]
Eine Überexpression von PGK1 wurde mit Magenkrebs in Verbindung gebracht und es wurde festgestellt, dass sie die Invasivität von Magenkrebszellen in vitro erhöht.[21] Das Enzym wird von Tumorzellen sezerniert und ist an der Angiogenese beteiligt, der zur Freisetzung von Angiostatin und zur Hemmung des Wachstums von Tumorblutgefäßen führt.[22]
Aufgrund seiner breiten Spezifität gegenüber Nukleotidsubstraten ist bekannt, dass PGK an der Phosphorylierung und Aktivierung von HIV-antiretroviralen Wirkstoffen auf Nukleotidbasis beteiligt ist.[15][23]
Weblinks
Einzelnachweise
- UniProt P00558.
- PGK2. In: Online Mendelian Inheritance in Man. (englisch).
- PGK1. In: Online Mendelian Inheritance in Man. (englisch).
- J. Wang et al.: A glycolytic mechanism regulating an angiogenic switch in prostate cancer. Cancer Res. 67/1/2007: 149–159; PMID 17210694.
- A. Dhar, A. Samiotakis, S. Ebbinghaus, L. Nienhaus, D. Homouz, M. Gruebele, M. S. Cheung: Structure, function, and folding of phosphoglycerate kinase are strongly perturbed by macromolecular crowding. In: Proceedings of the National Academy of Sciences. Band 107, Nummer 41, Oktober 2010, S. 17586–17591, doi:10.1073/pnas.1006760107, PMID 20921368, PMC 2955104 (freier Volltext).
- S. Kumar, B. Ma, C. J. Tsai, H. Wolfson, R. Nussinov: Folding funnels and conformational transitions via hinge-bending motions. In: Cell biochemistry and biophysics. Band 31, Nummer 2, 1999, S. 141–164, doi:10.1007/BF02738169, PMID 10593256 (Review).
- L. R. Chiarelli, S. M. Morera, P. Bianchi, E. Fermo, A. Zanella, A. Galizzi, G. Valentini: Molecular insights on pathogenic effects of mutations causing phosphoglycerate kinase deficiency. In: PLOS ONE. Band 7, Nummer 2, 2012, S. e32065, doi:10.1371/journal.pone.0032065, PMID 22348148, PMC 3279470 (freier Volltext).
- J. M. Yon, M. Desmadril, J. M. Betton, P. Minard, N. Ballery, D. Missiakas, S. Gaillard-Miran, D. Perahia, L. Mouawad: Flexibility and folding of phosphoglycerate kinase. In: Biochimie. Band 72, Nummer 6–7, 1990 Jun-Jul, S. 417–429, doi:10.1016/0300-9084(90)90066-p, PMID 2124145 (Review).
- L. Zerrad, A. Merli, G. F. Schröder, A. Varga,.. Gráczer, P. Pernot, A. Round, M. Vas, M. W. Bo: A spring-loaded release mechanism regulates domain movement and catalysis in phosphoglycerate kinase. In: Journal of Biological Chemistry. Band 286, Nummer 16, April 2011, S. 14040–14048, doi:10.1074/jbc.M110.206813, PMID 21349853, PMC 3077604 (freier Volltext).
- A. Varga, Z. Palmai, Z. Gugolya,.. Gráczer, F. Vonderviszt, P. Závodszky, E. Balog, M.: Importance of aspartate residues in balancing the flexibility and fine-tuning the catalysis of human 3-phosphoglycerate kinase. In: Biochemistry. Band 51, Nummer 51, Dezember 2012, S. 10197–10207, doi:10.1021/bi301194t, PMID 23231058.
- M. J. Cliff, M. W. Bowler, A. Varga, J. P. Marston, J. Szabó, A. M. Hounslow, N. J. Baxter, G. M. Blackburn, M. Vas, J. P. Waltho: Transition state analogue structures of human phosphoglycerate kinase establish the importance of charge balance in catalysis. In: Journal of the American Chemical Society. Band 132, Nummer 18, Mai 2010, S. 6507–6516, doi:10.1021/ja100974t, PMID 20397725.
- R. D. Banks, C. C. F. Blake, P. R. Evans, R. Haser, D. W. Rice, G. W. Hardy, M. Merrett, A. W. Phillips: Sequence, structure and activity of phosphoglycerate kinase: a possible hinge-bending enzyme. In: Nature. 279, 1979, S. 773, doi:10.1038/279773a0.
- B. E. Bernstein, W. G. Hol: Crystal structures of substrates and products bound to the phosphoglycerate kinase active site reveal the catalytic mechanism. In: Biochemistry. Band 37, Nummer 13, März 1998, S. 4429–4436, doi:10.1021/bi9724117, PMID 9521762.
- M. Larsson-Raźnikiewicz: Kinetic studies on the reaction catalyzed by phosphoglycerate kinase. II. The kinetic relationships between 3-phosphoglycerate, MgATP2-and activating metal ion. In: Biochimica et Biophysica Acta. Band 132, Nummer 1, Januar 1967, S. 33–40, doi:10.1016/0005-2744(67)90189-1, PMID 6030358.
- A. Varga, L. Chaloin, G. Sági, R. Sendula, E. Gráczer, K. Liliom, P. Závodszky, C. Lionne, M. Vas: Nucleotide promiscuity of 3-phosphoglycerate kinase is in focus: implications for the design of better anti-HIV analogues. In: Molecular bioSystems. Band 7, Nummer 6, Juni 2011, S. 1863–1873, doi:10.1039/c1mb05051f, PMID 21505655.
- Märtha Larsson-Raźnikiewicz, Eva Wiksell: Inhibition of phosphoglycerate kinase by salicylates. In: Biochimica et Biophysica Acta - Enzymology. 523, 1978, S. 94, doi:10.1016/0005-2744(78)90012-8.
- A. Yoshida, K. Tani: Phosphoglycerate kinase abnormalities: functional, structural and genomic aspects. In: Biomedica biochimica acta. Band 42, Nummer 11–12, 1983, S. S263–S267, PMID 6689547.
- E. Beutler: PGK deficiency. In: British Journal of Haematology. Band 136, Nummer 1, Januar 2007, S. 3–11, doi:10.1111/j.1365-2141.2006.06351.x, PMID 17222195 (Review).
- Phosphoglycerate kinase deficiency. In: Genetics Home Reference. United States National Library of Medicine, 29. Oktober 2019, abgerufen am 1. November 2019.
- M. Rhodes, L. Ashford, B. Manes, C. Calder, J. Domm, H. Frangoul: Bone marrow transplantation in phosphoglycerate kinase (PGK) deficiency. In: British Journal of Haematology. Band 152, Nummer 4, Februar 2011, S. 500–502, doi:10.1111/j.1365-2141.2010.08474.x, PMID 21223252.
- D. Zieker, I. Königsrainer, I. Tritschler, M. Löffler, S. Beckert, F. Traub, K. Nieselt, S. Bühler, M. Weller, J. Gaedcke, R. S. Taichman, H. Northoff, B. L. Brücher, A. Königsrainer: Phosphoglycerate kinase 1 a promoting enzyme for peritoneal dissemination in gastric cancer. In: International Journal of Cancer. Band 126, Nummer 6, März 2010, S. 1513–1520, doi:10.1002/ijc.24835, PMID 19688824, PMC 2811232 (freier Volltext).
- A. J. Lay, X. M. Jiang, O. Kisker, E. Flynn, A. Underwood, R. Condron, P. J. Hogg: Phosphoglycerate kinase acts in tumour angiogenesis as a disulphide reductase. In: Nature. Band 408, Nummer 6814, Dezember 2000, S. 869–873, doi:10.1038/35048596, PMID 11130727.
- S. Gallois-Montbrun, A. Faraj, E. Seclaman, J. P. Sommadossi, D. Deville-Bonne, M. Véron: Broad specificity of human phosphoglycerate kinase for antiviral nucleoside analogs. In: Biochemical pharmacology. Band 68, Nummer 9, November 2004, S. 1749–1756, doi:10.1016/j.bcp.2004.06.012, PMID 15450940.