Caesiumacetat
Caesiumacetat ist das Caesiumsalz der Essigsäure mit der Konstitutionsformel CH3COOCs oder auch in der anorganischen Salzschreibweise Cs(CH3COO).
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
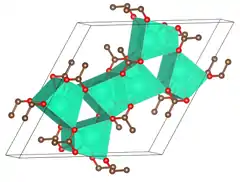 | ||||||||||||||||
| _ Cs _ O _ C | ||||||||||||||||
| Kristallsystem |
hexagonal | |||||||||||||||
| Raumgruppe |
P6/m (Nr. 175) | |||||||||||||||
| Gitterparameter |
a = 1488,0 pm, c = 397,65 pm | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Caesiumacetat | |||||||||||||||
| Andere Namen |
Caesiumethanoat (nach IUPAC) | |||||||||||||||
| Verhältnisformel | C2H3CsO2 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 191,96 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
100 g/l bei 11 °C[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Caesiumacetat kann durch Salzbildungsreaktion aus Caesiumhydroxid und Essigsäure hergestellt werden.
Ebenso ist die Synthese aus Caesiumcarbonat und Essigsäure unter Entwicklung von Kohlendioxid möglich.
Eigenschaften
Wasserfreies Caesiumacetat kristallisiert im hexagonalen Kristallsystem[5] in der Raumgruppe P6/m (Raumgruppen-Nr. 175) mit den Gitterparametern a = 1488,0 pm und c = 397,65 pm. In der Elementarzelle befinden sich sechs Formeleinheiten.[6]
Die thermische Zersetzung von Caesiumacetat ist bei 450 °C abgeschlossen. Als Endprodukt entsteht Caesiumoxid.[7]
Verwendung
Caesiumacetat findet als Reagens bei der Perkin-Reaktion Verwendung, wo es das sonst übliche Natriumacetat ersetzen kann.[8]
Einzelnachweise
- Datenblatt Caesiumacetat bei Acros, abgerufen am 20. Mai 2010.
- Datenblatt Cesium acetate (PDF) bei Strem, abgerufen am 25. Dezember 2012.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Inorganic Compounds, S. 4-57.
- Datenblatt Cesium acetate bei Sigma-Aldrich, abgerufen am 25. Mai 2011 (PDF).
- J. Hatibarua, G. S. Parry: A crystallographic study of the acetates of potassium, rubidium and caesium. In: Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 28, Nr. 10, 15. Oktober 1972, S. 3099–3100. doi:10.1107/S0567740872007496. Abgerufen am 1. Juli 2012.
- A. Lossin, G. Meyer: "Kristallstruktur von Caesiumacetat, Cs(CH3COO)" in Zeitschrift für anorganische und allgemeine Chemie, 1993, 619 (8), S. 1462–1464; doi:10.1002/zaac.19936190823.
- U. Meyer, H. Gorzawski, W. F. Hölderich: "Michael addition of ethyl acrylate and acetone over solid bases" in Catalysis Letters, 1999, 59, S. 201–206; doi:10.1023/A:1019020504961.
- E. Koepp, F. Vögtle: "Perkin-Synthese mit Cäsiumacetat" in Synthesis, 1987, 1987 (2), S. 177–179; doi:10.1055/s-1987-27880.