Dihydropteroat-Synthase
Die Dihydropteroat-Synthase (DHPS) ist ein Enzym, das im Folsäure-Stoffwechsel von Bakterien, Pilzen und Pflanzen vorkommt, nicht aber in Tieren.[1] In Archaeen ist die Dihydropteroat-Synthase an der Biosynthese von Methanopterin beteiligt.[1] In Tieren wird Folsäure nicht hergestellt und ist ein Vitamin, das über die Nahrung zugeführt werden muss.
| Dihydropteroate synthase type-1 | ||
|---|---|---|
| ||
| nach PDB 1AJ0 | ||
| Andere Namen |
Dihydropteroate pyrophosphorylase type I, Dihydropteroate synthase type I, DHPS | |
| Masse/Länge Primärstruktur | 30.126 Da / 279 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer oder Homotrimer | |
| Bezeichner | ||
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 2.5.1.15 | |
| Substrat | (7,8-Dihydropterin-6-yl)methyl-diphosphat + 4-Aminobenzoat | |
| Produkte | 7,8-Dihydropteroat + PPi | |
| Orthologe | ||
| E. coli | S. cerevisiae | |
| Entrez | 1446559 | 855465 |
| UniProt | P0C002 | P53848 |
| PubMed-Suche | 1446559 | 855465 |
Eigenschaften
Die Dihydropteroat-Synthase katalysiert folgende Reaktion:
(7,8-Dihydropterin-6-yl)methyl-diphosphat + 4-Aminobenzoat (PABA) 7,8-Dihydropteroat (H2Pte) + Diphosphat
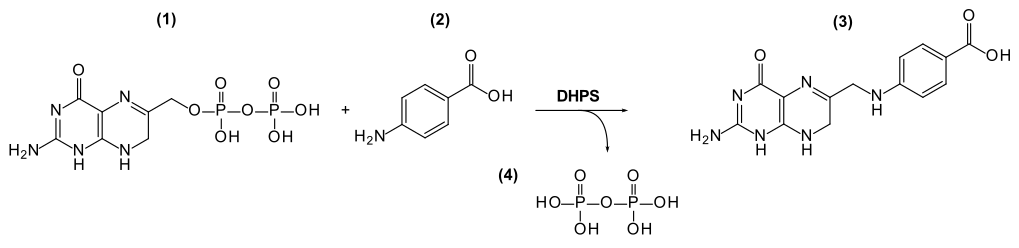
Die Sulfonamide, eine Klasse von Antibiotika, sind kompetitive Hemmstoffe der Bindung von 4-Aminobenzoat an der Dihydropteroat-Synthase. Allerdings haben verschiedene Pathogene Resistenzmechanismen gegen die Hemmung durch Sulfonamide entwickelt,[2] unter anderem durch Punktmutationen in der Dihydropteroat-Synthase, wie Plasmodium falciparum gegen Sulfadoxin-Pyrimethamin[3] oder Pneumocystis jirovecii gegen Trimethoprim und Sulfamethoxazol.[4] In Escherichia coli liegt das Gen für die Dihydropteroat-Synthase (Gen sulI) auf verschiedenen Resistenz-Plasmiden und auf Tn21-verwandten Transposons.[5] Das Plasmid pDGO100 enthält zwei Kopien von sulI.[5]
In Pflanzen wie Arabidopsis thaliana ist die Dihydropteroat-Synthase ein Teil eines mitochondrialen Enzymkomplexes aus zwei Enzymen mit der 2-Amino-4-hydroxy-6-hydroxymethyldihydropteridin-Diphosphokinase,[6] ebenso im Pilz Pneumocystis jirovecii (Gen fas).[7] Im Hefepilz Saccharomyces cerevisiae besitzt dieser Enzymkomplex (Dihydropteroat-Synthase-Gen fol1) noch ein drittes Enzym, die Dihydroneopterin-Aldolase.[8]
Literatur
- C. Capasso, C. T. Supuran: Sulfa and trimethoprim-like drugs - antimetabolites acting as carbonic anhydrase, dihydropteroate synthase and dihydrofolate reductase inhibitors. In: Journal of enzyme inhibition and medicinal chemistry. Band 29, Nummer 3, Juni 2014, S. 379–387, doi:10.3109/14756366.2013.787422, PMID 23627736.
Weblinks
Einzelnachweise
- EC 2.5.1.15. In: sbcs.qmul.ac.uk. Abgerufen am 9. Juli 2018.
- M. K. Yun, Y. Wu, Z. Li, Y. Zhao, M. B. Waddell, A. M. Ferreira, R. E. Lee, D. Bashford, S. W. White: Catalysis and sulfa drug resistance in dihydropteroate synthase. In: Science. Band 335, Nummer 6072, März 2012, S. 1110–1114, doi:10.1126/science.1214641, PMID 22383850, PMC 3531234 (freier Volltext).
- A. Heinberg, L. Kirkman: The molecular basis of antifolate resistance in Plasmodium falciparum: looking beyond point mutations. In: Annals of the New York Academy of Sciences. Band 1342, April 2015, S. 10–18, doi:10.1111/nyas.12662, PMID 25694157, PMC 4405445 (freier Volltext) (Review).
- Y. S. Huang, J. J. Yang, N. Y. Lee, G. J. Chen, W. C. Ko, H. Y. Sun, C. C. Hung: Treatment of Pneumocystis jirovecii pneumonia in HIV-infected patients: a review. In: Expert review of anti-infective therapy. Band 15, Nummer 9, 09 2017, S. 873–892, doi:10.1080/14787210.2017.1364991, PMID 28782390.
- sulI - Dihydropteroate synthase type-1 - Escherichia coli - sulI gene & protein. In: uniprot.org. 20. Juni 2018, abgerufen am 9. Juli 2018 (englisch).
- S. Storozhenko, O. Navarrete, S. Ravanel, V. De Brouwer, P. Chaerle, G. F. Zhang, O. Bastien, W. Lambert, F. Rébeillé, D. Van Der Straeten: Cytosolic hydroxymethyldihydropterin pyrophosphokinase/dihydropteroate synthase from Arabidopsis thaliana: a specific role in early development and stress response. In: Journal of Biological Chemistry. Band 282, Nummer 14, April 2007, S. 10749–10761, doi:10.1074/jbc.M701158200, PMID 17289662.
- F. Volpe, M. Dyer, J. G. Scaife, G. Darby, D. K. Stammers, C. J. Delves: The multifunctional folic acid synthesis fas gene of Pneumocystis carinii appears to encode dihydropteroate synthase and hydroxymethyldihydropterin pyrophosphokinase. In: Gene. Band 112, Nummer 2, März 1992, S. 213–218, PMID 1313386.
- U. Güldener, G. J. Koehler, C. Haussmann, A. Bacher, J. Kricke, D. Becher, J. H. Hegemann: Characterization of the Saccharomyces cerevisiae Fol1 protein: starvation for C1 carrier induces pseudohyphal growth. In: Molecular biology of the cell. Band 15, Nummer 8, August 2004, S. 3811–3828, doi:10.1091/mbc.e03-09-0680, PMID 15169867, PMC 491839 (freier Volltext).