Nuclear Speckle
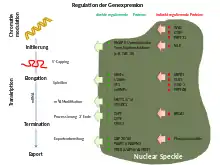
Nuclear Speckles (englisch etwa „Kernsprenkel“), auch Interchromatin Granule Clusters (ICG) genannt, sind Bereiche im Zellkern, die mit Spleißfaktoren angereichert sind. Sie befinden sich in den Interchromatin-Regionen des Nukleoplasmas von Säugerzellen. Immunfluoreszenzmikroskopisch betrachtet, erscheinen sie in der Regel als unregelmäßig geformte, unterschiedlich große Strukturen im Zellkern. Pro Zellkern finden sich 20 bis 50 Speckles. Diese Objekte sind dynamische Strukturen: Ihre Bestandteile können sich kontinuierlich mit dem Nukleoplasma und anderen Kernbereichen austauschen, einschließlich aktiver Transkriptionsstellen.
In ihnen reichern sich in hoher lokaler Konzentration snRNPs und andere Spleißfaktoren an. Das Vorhandensein vieler anderer Faktoren, die an der mRNA-Produktion durch die RNA-Polymerase II beteiligt sind, in den Speckles unterstützt ihre enge Beziehung zur Genexpression. Obwohl die meisten Speckles anscheinend keine DNA enthalten, können dennoch hochexprimierte Gene im Zusammenhang mit Speckles gefunden werden. Dies stimmt überein mit einer wichtigen Rolle der Speckles bei der Koordination der Bereitstellung und/oder des Recyclings von Faktoren für die Transkription und der mRNA-Prozessierung.
Studien über die Zusammensetzung, Struktur und Dynamik von Speckles haben ein wichtiges Paradigma für das Verständnis der funktionellen Organisation des Kerns und der Dynamik der Genexpressionsmaschine geliefert.[1][2]
Geschichte
Nuclear Speckles wurden zuerst als Speicher- und Modifikationsstellen für Spleißfaktoren erkannt. Weitere Studien über Transkription und mRNA-Reifung und -Export zeigten eine allgemeinere Rolle der Speckles für das Spleißen im RNA-Stoffwechsel.[2]
Die erste detaillierte Beschreibung der Nuclear Speckles wurde 1910 von Santiago Ramón y Cajal erstellt. Ramón y Cajal benutzte saure Anilinfärbungen, um Strukturen zu identifizieren, die er als "grumos hialinas" bezeichnete. Der Begriff "Speckle" wurde erstmals 1961 von J. Swanson Beck nach der Untersuchung von Rattenleberabschnitten geprägt. Zwei Jahre zuvor wurden diese Flecken von Hewson Swift auf elektronenmikroskopischer Ebene identifiziert. Er bezeichnete sie als und als Interchromatinpartikel. Eine Verbindung zu diesem Zeitpunkt wurde nicht hergestellt wurde. Swift beobachtete, dass diese Partikel nicht zufällig verteilt waren, sondern in lokalisierten "Wolken" auftraten. Zytochemische Analysen zeigten, dass sie RNA enthielten. Der erste Zusammenhang zwischen Prä-mRNA-Spleißung und Nuclear Speckles oder den Interchromatin Granule Clustern ergab sich jedoch aus einer Untersuchung der Verteilung von snRNPs mit Anti-Spleißfaktor-spezifischen Antikörpern, die ein gesprenkeltes Verteilungsmuster von snRNPs in Zellkernen zeigte.[1] Mit fortschreitender Forschung zu den Nuclear Speckles wurden jedoch zusätzliche Funktionen entdeckt.[2]
Aufbau
Der menschliche Interphasen-Zellkern enthält 20–50 Nuclear Speckles mit einem Durchmesser von einem bis zu mehreren Mikrometern. Durch elektronenmikroskopische Aufnahmen wurde festgestellt, dass ein einzelnes Nuclear Speckle aus Punkten (Interchromatin-Granule) mit einem Durchmesser von 20–25 nm besteht. Diese sind durch feine Fibrillen zu einem Cluster verbunden. Ihre Größe und Form kann sich dynamisch ändern. Sie kann zwischen verschiedenen Zelltypen variieren und hängt von zahlreichen Faktoren ab, darunter u. a. den zellulären ATP-Werten, dem Phosphorylierungsstatus verschiedener Proteine, der Transkription von stress-aktivierten Genen und die Transkription und Spleißung der RNA-Polymerase II. Die Hemmung der Transkription durch die RNA-Polymerase II oder des Spleißens führt zur Anhäufung von Proteinen in vergrößerten Nuclear Speckles. Nach Beseitigung dieser Hemmung kann die normale Größe der Speckles wieder hergestellt werden.[2] Für einige der Komponenten der Speckles wurde ein Zielsignal identifiziert. Die Arginin/Serin-reiche Domäne (RS-Domäne) einiger SR-Prä-mRNA-Spleißfaktoren hat sich als notwendig und ausreichend erwiesen, um Speckles als Ziel für diese Proteine zu definieren.[1]
Die biophysikalischen Eigenschaften der Nuclear Speckles und des Nukleoplasmas unterscheiden sich nicht wesentlich. Speckles sind etwas dichter als das umgebende Nukleoplasma, und die Proteinkonzentrationen (zwischen 115 und 162 mg/ml) sind in beiden Kompartimenten ähnlich. Obwohl Nuclear Speckles hochdynamische Strukturen sind und ihre Komponenten ständig im Fluss sind, bleiben Speckles klar vom Nukleoplasma getrennt. Bei der Isolierung aus den Kernen von Mausleberzellen blieben sie stabil und widerstandsfähig gegenüber nachfolgenden Schritten im Aufreinigungsverfahren.[2]
Es ist allgemein akzeptiert, dass der Zusammenbau der Nuclear Speckles von den Interaktionen zwischen deren einzelnen Komponenten abhängt. Neben strukturierten Proteindomänen spielen Low-Complexity-Regions (LCRs) eine wichtige Rolle bei Protein-Protein- und Protein-RNA-Interaktionen. LCRs sind repetitive Sequenzen von Aminosäuren in Proteinen und sind sehr flexibel. Diese LCRs sind in den Proteinen der Nuclear Speckles überrepräsentiert. LCRs können die Eigenschaften eines Proteins nach posttranslationaler Modifikation oder bei Proteinpartnerbindung dauerhaft oder vorübergehend verändern. So werden Proteine, die LCRs enthalten, reguliert und sorgen damit dafür, dass zelluläre Prozesse angepasst werden können. Der Abbau oder Mutation in diesen LCR-Regionen verändert die Protein-Protein-Interaktionen, Protein-RNA-Interaktionen, Protein-Funktionen oder die Lokalisierung von Proteinen zu den Nuclear Speckles.
Die Trennung von Proteinen in den Nuclear Speckles ermöglicht diesen den Schutz vor ungünstigen Wechselwirkungen und gewährleistet die Integrität von Nuclear Speckles trotz des Fehlens einer Lipidgrenze.[2]
Zusammensetzung
Ähnlich wie andere membranlose Körper mit flüssigkeitsähnlichen Eigenschaften zeichnen sich Nuclear Speckles durch den dynamischen Austausch von Komponenten innerhalb des Nukleoplasmas aus. Sie teilen sich einige Proteine mit anderen Kernkörpern. So werden beispielsweise spleißosomale snRNPs vor ihrem Transport in die Nuclear Speckles in Cajal-Körpern zusammengebaut. Zudem regeln sie die Reifung der 3′ Enden von Histon-Transkripten in Histon-Locus-Körpern (HLB).[2]
Die Anzahl der Proteine, die in Nuclear Speckles gefunden wurden, hat durch mikroskopische und proteomische Studien erheblich zugenommen. Proteine der Nuclear Speckles sind an mehreren Schritten der nukleären Genexpressionsregulation beteiligt, wie z. B. epigenetische Regulation, Transkriptionsaktivator- und Repressorfunktionen, Transkriptionselongation und -terminierung, Spleißen, 3′ Ende-Verarbeitung, mRNA-Modifikation und -Export. Die Lokalisation, Wechselwirkungen und der Abbau dieser Proteine wird durch Regulierungsproteine der Nuclear Speckles reguliert. Zu diesen gehören Proteinkinasen und Proteine, die an der Phosphoinositid-Signalisierung, der Organisation des Cytoskeletts und der Ubiquitinierung beteiligt sind.
Proteinkinasen
Post-translationale Proteinmodifikationen, die Proteineigenschaften verändern können, gehören zu den wichtigsten Funktionen der Nuclear Speckles. Basierend auf ihrer Proteinzusammensetzung scheinen Nuclear Speckles Kernzentren für die Proteinphosphorylierung, Methylierung, Acetylierung, Ubiquitinierung und SUMOylierung zu sein. Da mehr als 30 % der menschlichen Proteine phosphoryliert werden können und Kinase-codierende Gene ca. 2,4 % der proteincodierenden menschlichen Gene ausmachen, ist die Proteinphosphorylierung ein grundlegender Regulationsmechanismus.
Insgesamt wurden (bis 2017) 31 Proteinkinasen in Nuclear Speckles gefunden und die Substrate vieler Proteinkinasen identifiziert. Da viele Proteine der Nuclear Speckles an verschiedenen Genexpressionsschritten beteiligt sind, die in verschiedenen zellulären Kompartimenten stattfinden, hat sich die Kontrolle des Transfers dieser Proteine zwischen Kern und Zytoplasma als wichtiges Instrument der Genexpressionsregulierung etabliert. Die reversible Proteinphosphorylierung spielt eine wichtige Rolle bei der korrekten zellulären Lokalisierung von Nuclear Speckle-Proteinen, einschließlich der SRSF-Proteine (Serine and arginine rich splicing factors). Die SRSF-Phosphorylierung/Dephosphorylierung dient als kritischer Mechanismus, der sowohl das Spleißen als auch die Proteinzusammensetzung in Nuclear Speckles beeinflusst. Dementsprechend führt eine erhöhte Aktivität oder Überexpression vieler Nuclear Speckle-Kinasen zu einem Abbau der Speckles. Dies weist auf eine Rolle der Kinasen bei der Erhaltung der Nuclear Speckles hin. Die Kinasen der Nuclear Speckles sind also Mediatoren, die verschiedene Signale über nukleäre Genexpressionsregulationsereignisse integrieren und anpassen, um das zelluläre Gleichgewicht zu halten.[2]
PI Signaling
Derivate von Phosphoinositol (PI) fungieren als eine weitere große Gruppe von Signalmolekülen, die für die Funktion der Nuclear Speckles relevant sind. Im Zellkern sind PIs an der Regulation der Genexpression beteiligt, einschließlich Chromatinmodifikation, Prä-mRNA-Reifung und mRNP-Export. Zahlreiche Nuclear-Speckle-Proteine sind direkt (bei PI-Bindung) oder indirekt von PIs durch die Aktivität von PI-abhängigen regulatorischen Proteinen (z. B. Proteinkinasen oder Ubiquitin-Ligasen) betroffen.
Immer mehr Hinweise deuten darauf hin, dass PIs in Nuclear Speckles lokalisiert sind. Darüber hinaus interagieren PI-modifizierende Enzyme, die Phosphate aus PIs hinzufügen oder entfernen oder hydrolysieren, in Nuclear Speckles miteinander. Dies deutet darauf hin, dass einige PI-Derivate in Nuclear Speckles hergestellt werden. Bisher (2017) wurden mehr als zwanzig Proteine, die an der PI-Signalisierung beteiligt sind, in Nuclear Speckles gefunden.
PIs können aufgrund der Funktionalität ihrer nachgeschalteten Signalproteine, zu denen mehrere prominente NS-Proteinkinasen gehören, einen erheblichen Einfluss auf die Nuclear Speckles-Funktion haben. Zusammengenommen bestärken diese Tatsachen die Ansicht, dass Nuclear Speckles nukleäre Knotenpunkte für die PI-Produktion und Signalisierung sind, die für die Proteinlokalisierung in Nuclear Speckles und deren Komponenten sowie für die Regulierung von Transkription, Transkriptreifung, Spleißung und Export wichtig sind.[2]
Organisation des Cytoskeletts
In proteomischen Studien wurden verschiedene Arten von Strukturproteinen in Nuclear Speckles identifiziert. Einige Studien zeigten, dass cytoskelettalen Proteine wie Lamine, Myosine und Tubulin Komponenten der Nuclear Speckles sind. Cytoskelettumlagerungen werden durch Nuclear-Speckles-Proteine reguliert, die an der PI-Signalisierung und der Calciumsignalisierung beteiligt sind. Dies deutet darauf hin, dass die funktionellen Zusammenhänge zwischen PIs, Calcium und Cytoskelettproteinen im Zytoplasma bei Nuclear Speckles ähnlich sind. Proteine, die in der Organisation des Cytoskeletts involviert sind, tragen zur Bildung des Zellkerns bei, regulieren aber auch die Transkription.[2]
Ubiquitinierung und SUMOylierung
Ein erheblicher Teil der Proteine von Nuclear Speckles wird kovalent an Ubiquitin oder ubiquitinähnliche Proteine gebunden. Obwohl aktive Proteasomen eine Rolle beim Proteinabbau bei Nuclear Speckles spielen und die Zusammenbau von Nuclear Speckles beeinflussen, markiert nur eine bestimmte Art der Polyubiquitination ein Protein für den proteasomalen Abbau. Die Ubiquitin-abhängige Regulation ist ein wichtiger Mechanismus für die Kontrolle des Spleißens. Die Ubiquitination erleichtert Protein-Protein-Interaktionen, die für die Spleißosomen-Bildung erforderlich sind.
Im Gegensatz dazu ist die SUMOylierung von Proteinen der Nuclear Speckles besser verstanden. Die Bindung von SUMO-1 ist ein typisches Signal, um Proteine an ein Nuclear Speckle zu binden. SUMOylierung ist an der Regulierung vieler anderer mit Nuclear Speckles assoziierten Prozesse beteiligt.[2]
RNAs
Zahlreiche Studien haben das Vorhandensein von RNAs, einschließlich polyadenylierter RNAs und nichtcodierender RNAs, in Nuclear Speckles nachgewiesen. Ein bedeutender Teil der gesamten nukleären polyadenylierten RNA ist innerhalb der Nuclear Speckles lokalisiert. Die Anreicherung einiger Transkripte in Nuclear Speckles hängt hauptsächlich von der Anwesenheit von Introns ab, aber auch Transkripte ohne Introns lokalisieren sich dort. Der nukleäre Export scheint der prominenteste Weg zu sein, der mRNAs reguliert, die sich in Nuclear Speckles befinden, da die Erschöpfung komplexer Komponenten des Transkriptionsexports (TREX) zu einer verbesserten Assoziation von mRNAs mit Nuclear Speckles führt. Der mRNA-Kernexport hängt von der aktiven Transkription, der vollständigen Polyadenylierung und dem Spleißen ab. Da die meisten Exons an der Transkriptionsstelle cotranskriptionell gespleißt werden, scheinen Nuclear Speckles der Ort der Transkriptreifung zu sein, die für den Kernexport benötigt wird.[2]
MALAT1 RNA
Eine lange, nicht-codierende RNA namens MALAT1 (metastasis-associated lung carcinoma transcript 1) übernimmt eine wichtige Rolle im Verhalten von Nuclear Speckles. MALAT1 beeinflusst das alternative Spleißen, indem es die Phosphorylierung und die daraus resultierende nukleäre Verteilung der Spleißfaktoren reguliert. Es rekrutiert auch Maschinerie für die Genaktivierung und die Bewegung von aktivem Chromatin zu den Nuclear Speckles. Mehrere Arten von SRSFs Proteinen sind mit MALAT1 verbunden. Sie binden sich direkt an deren Erkennungsstelle am Ende von 5′ von MALAT1. Darüber hinaus bindet MALAT1 andere Proteine. Seine Lokalisation zu den Nuclear Speckles hängt von verschiedenen anderen Proteinen ab. Es ist bekannt, dass MALAT1 direkt mit nukleären RNAs wie U1 snRNA interagiert. MALAT1 interagiert auch mit Chromatin an aktiv gespleißten Genen in der Nähe von Polyadenylierungsstellen.[2]
Funktionen
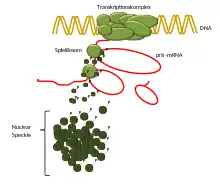
Neuere Studien haben gezeigt, dass Proteine, die an der Chromosomenlokalisierung, Chromatinmodifikation, Transkription, Spleißung, 3′ Endverarbeitung, mRNA-Modifikation und dem Export von Messenger-Ribonukleoprotein (mRNP) beteiligt sind, in den Nuclear Speckles synthetisiert werden. Dies unterstützt die Hypothese, dass Nuclear Speckles als 'Drehscheibe' dienen, um alle Schritte der Regulierung der nukleären Genexpression zu koordinieren.[2]
Alle diese Schritte sind mit der Transkription durch die RNA-Polymerase II gekoppelt. Diese findet in unmittelbarer Nähe zu den Speckles statt. Trotz vieler Studien, die darauf abzielen, die Proteine der Nuclear Speckles funktionell zu charakterisieren, bedarf es weiterer Forschung, die Rolle der Speckles zu ermitteln. Dieser Bedarf an zusätzlichen Studien gilt auch für ausführlich untersuchte Prozesse, wie z. B. das Spleißen, denn neben der konventionellen Sichtweise, dass Nuclear Speckles bei der Synthese, Modifikation, Zwischenlagerung und dem Recycling von Spleißfaktoren beteiligt sind, haben mehrere Berichte auch eine Spleißaktivität innerhalb der Speckles gezeigt.[2]
Kinasen, Cytoskelettproteine und Enzyme des Ubiquitin- und PI-Metabolismus sind prominente Regulatoren der nukleären Genexpression mit einer bekannten Rolle bei der Transkription und Spleißregulierung. Sie stellen jedoch nur einen kleinen Teil des NS-Proteoms dar. Die größte Gruppe von Nuclear Speckle-Proteinen ist an der Transkription beteiligt und beinhaltet Transkriptionsfaktoren und Chromatin-Remodellierungsfaktoren.[2]
Die Bildung von Nuclear Speckles und deren Funktion sind eng mit der aktiven Transkription verbunden. RNA-Polymerase II integriert die Transkriptsynthese mit der DNA-Vorlage und den DNA-regulierenden Proteinen einerseits und der RNA-Reifung und dem Export andererseits. Insbesondere die mRNA 3′ Endverarbeitung und Polyadenylierung, mRNA m6A Methylierung, Durchführung des mRNA-Kernexports und der Chromatinregulation sind ebenfalls direkt mit dem Spleißen gekoppelt.
Dementsprechend spielen mehr als 30 Nuclear-Speckle-Proteine sowohl bei der Transkription als auch beim Spleißen eine wichtige Rolle. Diese Prozesse sind nicht nur funktionell, sondern auch durch physikalische Protein-Protein-Interaktionen miteinander verbunden.[2]
Es wird angenommen, dass das Spleißen die Rate der RNA-Synthese beeinflusst, indem es das Pausieren der RNA-Polymerase II fördert. Umgekehrt fördert die Verlangsamung von RNA-Polymerase II die Akkumulation von RNA-Polymerase II in den Intron-Regionen, die die alternativen Exons flankieren. Dies ermöglicht die Rekrutierung von Aktivatoren oder Repressoren des alternativen Spleißens. Diese können die Einbindung oder das Übergehen von Exons fördern. Prä-mRNA-Spleißen und negative Regulation der Transkriptionsverlängerung werden durch Nuclear-Speckle-lokalisierte Proteine gekoppelt.
Epigenetische Mechanismen der Genexpressionsregulation dienen als weiteres wichtiges Bindeglied zwischen Transkription und Spleißen. Transkription und Spleißen sind weitgehend an der Regulation von Chromatinstruktur und -funktion beteiligt. Da viele DNA-regulierende Proteine in Nuclear Speckles gefunden wurden, ist die Rolle von Spleißfaktoren und Nuclear Speckles in der DNA-Regulation ein wichtiges Ziel für die zukünftige Forschung.[2]
mRNP-Reifung und Export
Proteine, die in Nuclear Speckles lokalisiert sind, beteiligen sich nicht nur an zahlreichen Aspekten der mRNA-Synthese und der mRNP-Reifung und sind für die Harmonisierung dieser Kernprozesse unerlässlich, sondern beeinflussen auch das cytoplasmatische mRNA-Verhalten.
Der letzte Schritt der mRNA-Synthese in fast allen Eukaryonten ist die Zugabe einer Poly(A)-Kette am 3′-Ende der mRNA (Polyadenylierung). Die wichtigsten Protein-Faktoren, die die endonukleolytische Spaltung und die anschließende Polyadenylierung regulieren und katalysieren, sind in den Nuclear Speckles lokalisiert. Es wird angenommen, dass bis zu 70 % der menschlichen mRNA-Transkripte einer alternativen Polyadenylierung unterzogen werden. Nuclear-Speckle-assoziierte Prozesse, einschließlich CTD-Phosphorylierung, epigenetische Regulation, N6-Methylierung von Adenosin (m6A) und das Spleißen, sind an der Auswahl der richtigen Stelle bei der alternativen Polyadenylierung beteiligt. Die m6A mRNA-Modifikation hat einen starken Einfluss auf die Orchestrierung der mRNP-Reifung. Das Vorhandensein aller wichtigen nukleären Elemente des m6A-Modifikationssystems in Nuclear Speckles deutet auf eine herausragende Rolle der Speckles in der m6A-Regulierung hin.
Die gegenseitige Beziehung zwischen mRNP-Reifung und dem Export-Mechanismus kann als Teil des mRNA-Qualitätssicherungssystems betrachtet werden. Dieses System wirkt sich auf die nukleäre Aufbewahrung von Transkripten aus, die spleißende, defekte Introns enthalten, die partielle Spleißosomen bilden. Dies erlaubt den Export von nur vollständig verarbeiteten mRNPs. Die Proteinzusammensetzung von mRNPs, die von Nuclear Speckles kontrolliert werden, kann jedoch auch den zytoplasmatischen RNA-Abbau beeinflussen. So regulieren Nuclear Speckles die mRNP-Bildung und die damit verbundene Exporteffizienz.
Zellzyklus
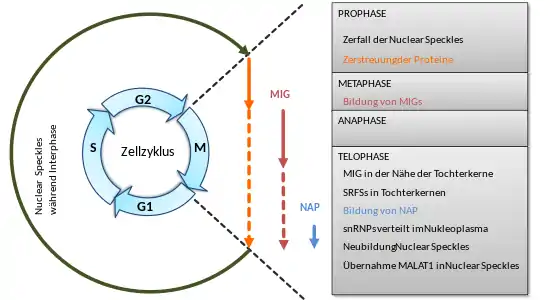
Nuclear Speckles sind während der Interphase sehr stabil. Die selbstorganisierenden Eigenschaften ihrer Komponenten müssen jedoch bei der Zellteilung gezielt unterdrückt werden. Die Störung der Kernhülle nach der Initiation der Mitose führt zu einem Abbau der Nuclear Speckles und einer Verteilung derer Proteine im Cytoplasma.[2]
Neben zu diesem Zeitpunkt beobachtbaren diffusen Mustern setzen sich die Proteine der Nuclear Speckles im Cytoplasma zu einer zunehmenden Anzahl von mitotischen Interchromatin-Granulaten (MIGs) zusammen, die von der Metaphase bis zur Telophase beobachtet werden. Die MIGs sind strukturell den Nuclear Speckles ähnlich. Da sich die Prä-mRNA-Spleißfaktoren unmittelbar nach dem Eintritt in den Kern in einem aktiven Zustand befanden, wurde postuliert, dass die MIGs für die Modifikation, den Zusammenbau und den Transport von Prä-mRNA-Verarbeitungskomplexen an Transkriptionsstellen in Tochterkernen benötigt werden.[2]
Nach der Rekonstruktion der Kernhülle verlagern sich die meisten Prä-mRNA-Spleißfaktoren allmählich innerhalb von 10 Minuten von den MIGs zum Kern, aber einige von ihnen (z. B. SRSF2) können in MIGs bleiben, bis zur G1-Phase.
Während der Telophase, vor der Neubildung der Nuclear Speckles, sammeln sich Spleißfaktoren in Tochterkernen vorübergehend (für 15–20 min) in der Nähe von aktiven Nukleolusorganisatorregionen an, den sogenannten NOR-assoziierten Patches (NAPs). Der Zusammenbau der Spleißfaktoren zu NAPs und MIGs bestätigt deren starke selbstorganisierenden Eigenschaften. Die Spleißfaktoren alleine reichen jedoch nicht aus, um Nuclear Speckles zu bilden. Daher sind zusätzliche Faktoren erforderlich, um Nuclear Speckles hervorzubringen. Da die Etablierung der Transkription in der Telophase der Bildung der Nuclear Speckles vorausgeht, wurde angenommen, dass die Rekrutierung von Spleiß- und Verarbeitungsfaktoren zu den neuen aktiven Transkriptsstellen die räumliche Anreicherung von Nuclear Speckles-Proteinen auslöst, gefolgt von der Keimbildung zum Aufbau der Speckles.
Die Akkumulation der Proteine zu Nuclear Speckles lässt sich durch ein Selbstorganisationsmodell erklären, welches auf Protein-Protein- und Protein-RNA-Interaktionen basiert. Die Einleitung des Zerfalls der Speckles während der Prophase erfordert jedoch zusätzliche unbekannte Faktoren. Cycline scheinen potenzielle Zellzyklusregulatoren für Speckles zu sein, da Cyclin L1 bisher das einzige immobile Protein in Nuclear Speckles der Interphase ist. Insgesamt sind die Mechanismen, die den zellzyklusabhängigen Auf- und Abbau von Nuclear Speckles orchestrieren, nach wie vor rätselhaft und bedürfen weiterer Untersuchungen.[2]
Einzelnachweise
- D. L. Spector, A. I. Lamond: Nuclear Speckles. In: Cold Spring Harbor Perspectives in Biology. Band 3, Nr. 2, 1. Februar 2011, ISSN 1943-0264, S. a000646–a000646, doi:10.1101/cshperspect.a000646, PMID 20926517, PMC 3039535 (freier Volltext).
- Lukasz Galganski, Martyna O. Urbanek, Wlodzimierz J. Krzyzosiak: Nuclear speckles: molecular organization, biological function and role in disease. In: Nucleic Acids Research. Band 45, Nr. 18, 13. Oktober 2017, ISSN 0305-1048, S. 10350–10368, doi:10.1093/nar/gkx759, PMID 28977640, PMC 5737799 (freier Volltext) – (oup.com [abgerufen am 24. April 2019]).
- Figure 5: A 'regulated-exchange' model accounts for the dynamics of nuclear speckles. In: Nature Reviews Molecular Cell Biology. ISSN 1471-0080 (nature.com [abgerufen am 1. Mai 2019]).