Nitroguanidin
Nitroguanidin (abgekürzt auch NiGu oder NQ) ist eine energiereiche, chemische Verbindung aus der Gruppe der Nitroimine, die als Komponente von Treibladungspulvern und Sicherheits-Sprengstoffen Bedeutung besitzt.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
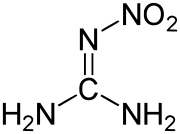 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Nitroguanidin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | CH4N4O2 | |||||||||||||||
| Kurzbeschreibung |
farbloser, kristalliner Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 104,06 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,77 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Nitroguanidin ist ein extrem unempfindlicher Sprengstoff, der trotz niedriger Detonationsenergie bei einer Dichte von 1,742 g/cm3 eine hohe Detonationsgeschwindigkeit (8344 m/s) und einen hohen Detonationsdruck von 29 GPa erreicht, was an die Leistungsdaten von Hexogen heranreicht[5].
Gewinnung und Darstellung
Nitroguanidin entsteht bei der Einwirkung von kalter konzentrierter Schwefelsäure auf Guanidiniumnitrat. Es kann auch durch die Umsetzung von Dicyandiamid mit Ammoniumnitrat bzw. auch durch die Reaktion von Harnstoff mit Ammoniumnitrat hergestellt werden.[2]
Eigenschaften
Nitroguanidin bildet farblose, orthorhombische, nadelförmige Kristalle aus. Seine röntgenographisch bestimmte Dichte beträgt 1,77 g/cm³, sein Schmelzpunkt liegt bei 239 °C (Subl., Zers.). Nitroguanidin ist nicht hygroskopisch. Es ist schwer löslich in kaltem Wasser, Methanol und Ethanol, löslich in heißem Wasser (langsame Hydrolyse), Säuren und Basen (Zersetzung).[2] Es bildet Additionsverbindungen mit Ketonen und Alkoholen.
Nitroguanidin bildet die zwei Kristallhabitus α-Nitroguanidin und β-Nitroguanidin, die diffraktometrisch identisch sind.[2] Beide Formen werden durch Umkristallisation aus Wasser, Eisessig oder Ammoniak nicht verändert. Wird β-Nitroguanidin in 96%iger Schwefelsäure gelöst und die Lösung in Wasser eingetragen, so scheidet sich α-Nitroguanidin ab.
Die thermische Zersetzung der Verbindung wird bei Temperaturen oberhalb von 150 °C relevant.[6] Als Zersetzungsprodukte werden Distickstoffmonoxid, Ammoniak, Stickstoffdioxid, Kohlenmonoxid und Kohlendioxid beobachtet.[6]
Explosionskenngrößen
Nitroguanidin ist sehr unempfindlich und detoniert nur nach Initiierung mit einem Zündverstärker. Wichtige Explosionskennzahlen sind:
- Explosionswärme 3062 kJ·kg−1.[4]
- Detonationstemperatur 2800 K bei Maximaldichte berechnet nach[7]
- Detonationsgeschwindigkeit: 8546 m·s−1 bei der Maximaldichte[4]
- Normalgasvolumen: 1075 l·kg−1.[8]
- Spezifische Energie: 932 kJ·kg−1[8]
- Detonationsdruck: 29 GPa[5]
- Detonationstemperatur: 2811 K[7]
- Bleiblockausbauchung: 305 cm3/10 g[8]
- Schlagempfindlichkeit bis 50 N·m keine Reaktion[2]
- Reibempfindlichkeit bis 353 N Stiftbelastung keine Reaktion[2]
- Kritischer Durchmesser bei einer Dichte von 1,52 g/cm3 < 14 mm[4]
- Stahlhülsentest bei einem Grenzdurchmesser 1 mm keine Entzündung.[2]
Die Detonationsgeschwindigkeit, vD, des Nitroguanidins steigt, wie bei allen Sprengstoffen, mit dessen Dichte an. vD folgt im Bereich von 0,3 bis 1,78 g·cm−3 folgendem Gesetz: vD = 1,44 + 4,015·Dichte [mm·µs−1][9] (siehe auch nachfolgende Grafik)
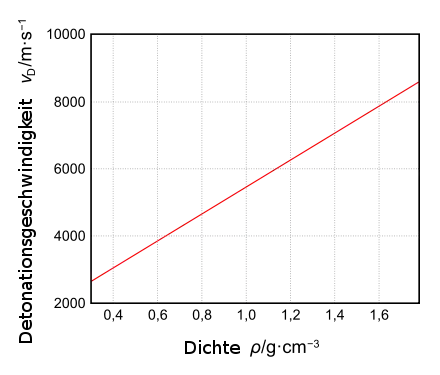
Nitroguanidin gehört zu den starken, aber schwer detonierenden Explosivstoffen. Dadurch erklärt sich die starke Abhängigkeit der Detonationsgeschwindigkeit vom Durchmesser. Eine Ladung mit einer Dichte von 0,95 g/cm3 hat in einem Rohr von 20 mm Innendurchmesser eine Detonationsgeschwindigkeit von 4340 m/s.
Verwendung
Nitroguanidin wird in gaserzeugenden pyrotechnischen Sätzen für Airbags und in sogenannten "kalten" dreibasigen Treibladungspulvern verwendet, welche die Läufe schonen und weniger Mündungsfeuer geben. NiGu wird als extrem unempfindlicher aber leistungsfähiger Explosivstoff in Sprengstoffen wie z. B. AFX-760, IMX-101 und AlIMX-101 verwendet.[5]
Nitroguanidin kommt als feinnadeliges LBDNQ (low bulk density nitroguanidine) sowie als körniges HBDNQ (high bulk density NQ) und sehr selten als kugeliges SHBDNQ (spherical high bulk density NQ) in den Handel.
Nitroguanidin ist ein Baustein für Insektizide aus der am schnellsten wachsenden Stoffklasse der Neonicotinoide, deren wichtigste Vertreter Imidacloprid (Bayer Crop Science), Clothianidin (Takeda, Bayer Crop Science), Thiamethoxam (Syngenta) und Dinotefuran (Mitsui Chemicals) sind.[10]
Struktur
In vielen Quellen wird für Nitroguanidin eine falsche Strukturformel angegeben, wonach NQ ein Nitramin wäre[11] Allerdings steht durch Neutronenbeugung[12] und 1H- sowie 15N-NMR Experimente[13] eindeutig fest, dass Nitroguanidin ein Nitroimin ist.
Einzelnachweise
- Eintrag zu 1-Nitroguanidin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- Ernst-Christian Koch: Insensitive High Explosives: III. Nitroguanidine – Synthesis – Structure – Spectroscopy – Sensitiveness. In: Propellants, Explosives, Pyrotechnics. Band 44, Nr. 3, März 2019, S. 267–292, doi:10.1002/prep.201800253.
- Datenblatt Nitroguanidine bei Sigma-Aldrich, abgerufen am 27. Januar 2013 (PDF).
- E.-C. Koch: Sprengstoffe, Treibmittel, Pyrotechnika. 2., vollständig überarbeitete Auflage. de Gruyter, Berlin, 2019, ISBN 978-3-11-055784-8.
- Ernst-Christian Koch: Insensitive high explosives: IV. Nitroguanidine – Initiation & detonation. In: Defence Technology. Band 15, Nr. 4, August 2019, S. 467–487, doi:10.1016/j.dt.2019.05.009.
- Yanchun Li, Yi Cheng: Investigation on the thermal stability of nitroguanidine by TG/DSC-MS-FTIR and multivariate non-linear regression. In: J. Therm. Anal. Calorim. 100, 2010, S. 949–953 (doi:10.1007/s10973-009-0666-3).
- R. Doherty, R. L. Simpson: Comparative Evaluation of several insensitive high explosives, 28th International Annual ICT Conference, June 1997, Karlsruhe, Germany. V-32.
- J. Köhler, R. Meyer, A. Homburg: Explosivstoffe. 10., vollständig überarbeitete Auflage. Wiley-VCH, Weinheim 2008, ISBN 978-3-527-32009-7.
- Terry R. Gibbs, Alphonse Popolato: LASL explosive property data. University of California Press, 1984, ISBN 0-520-04012-0, S. 52–60 (eingeschränkte Vorschau in der Google-Buchsuche).
- P. Maienfisch: Synthesis and Properties of Thiamethoxam and Related Compounds. In: Zeitschrift für Naturforschung B. 61, 2006, S. 353–359 (PDF, freier Volltext).
- J. Köhler, R. Meyer, A. Homburg, Explosivstoffe. 10. Auflage. Wiley-VCH, Weinheim, 2008, S. 216–217.
- C. S. Choi: Refinement of 2-Nitroguanidine by Neutron Powder Diffraction. In: Acta Cryst. B. 37, 1981, S. 1955–1957. doi:10.1107/S0567740881007735.
- S. Bulusu, R. L. Dudley, J. R. Autera: Structure of Nitroguanidine: Nitroamine or Nitroimine? New NMR Evidence from 15N-Labeled Sample and 15N Spin Coupling Constants. In: Magnetic Resonance in Chemistry. 25, 1987, S. 234–238. doi:10.1002/mrc.1260250311.
