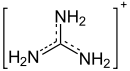
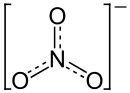
Guanidiniumnitrat
Guanidiniumnitrat, das Guanidinsalz der Salpetersäure, ist ein durchsichtiger bis weißer, brandfördernder kristalliner Feststoff.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
  | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Guanidiniumnitrat | ||||||||||||||||||
| Andere Namen |
Guanidinsalpeter | ||||||||||||||||||
| Summenformel | CH6N4O3 | ||||||||||||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 122,08 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,44 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
Zersetzung ab 250 °C[1] | ||||||||||||||||||
| Löslichkeit |
leicht in Wasser (160 g·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Darstellung
Guanidiniumnitrat kann durch Eintragen von Salpetersäure in Guanidin- oder Guanidiniumcarbonatlösung dargestellt werden. Die Reaktion kann stark exotherm verlaufen, daher muss die Temperatur ständig kontrolliert werden.
Eine andere Möglichkeit ist das gemeinsame Erhitzen von Ammoniumnitrat mit Harnstoff oder Dicyandiamid auf 210–230 °C.[2] Während das Reaktionsgemisch flüssig ist, muss es vor jeglicher Erschütterung geschützt werden und darf nicht umgerührt werden, da mechanische Störungen zu einem rasanten Temperaturanstieg führen können, was dazu führt, dass die Reaktion durchgeht und unkontrollierbare Nebenreaktionen auftreten.
Eigenschaften
Guanidinnitrat bildet farblose Kristalle mit einem Schmelzpunkt von 214 °C. Es ist gut löslich in Wasser.[1] Guanidinnitrat ist ein explosionsfähiger, brandfördernder Stoff mit vergleichbaren Eigenschaften wie Ammoniumnitrat. Im Stahlhülsentest ergibt sich ein Grenzdurchmesser von 2,5 cm.[3] Die Bleiblockausbauchung beträgt 240 cm3/10 g.[3] Die Verbindung ist nicht schlag- bzw. reibempfindlich.[3] Sie kann aber durch eine Zündkapsel mit Booster zur Detonation gebracht werden. Mit einigen organischen Stoffen und manchen Metallpulvern bildet es auch hochexplosive Mischungen. Die Explosionswärme beträgt 2449 kJ·kg−1.[3] Im Gegensatz zu den meisten anderen organischen Salpetersäure-Salzen, wie zum Beispiel Harnstoffnitrat, reagiert es in wässriger Lösung nicht sauer. Dies hat es dem stark basischen Charakter des Guanidins zu verdanken. Obwohl es ein organisches Nitrat ist, ist es jedoch kein Salpetersäure-Ester, wie beispielsweise Glycerinnitrat oder Cellulosenitrat.
Verwendung
Während des Zweiten Weltkriegs wurde es aus Rohstoffmangel zusammen mit Ammoniumnitrat und Zusätzen von Hexogen in schmelzbaren Mischungen verwendet. Heutzutage dient es überwiegend als Ausgangsstoff für die Synthese von Nitroguanidin.
Einzelnachweise
- Eintrag zu Guanidiniumnitrat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Eintrag zu Guanidin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 17. Dezember 2019.
- Köhler, J.; Meyer, R.; Homburg, A.: Explosivstoffe, zehnte, vollständig überarbeitete Auflage. Wiley-VCH, Weinheim 2008, ISBN 978-3-527-32009-7.

