Myxobolus cerebralis
Myxobolus cerebralis ist ein Parasit aus der Gruppe der Myxozoa. Er befällt Forellenfische (Salmonidae) wie Forellen, Saiblinge und Lachse und verursacht bei ihnen die Drehkrankheit. Die frühesten Beschreibungen der Krankheit stammen von Beständen der Regenbogenforelle in Deutschland um 1900, die Erstbeschreibung des Parasiten durch Bruno Hofer erfolgte 1903. Seitdem hat sich die Krankheit weltweit ausgebreitet und ist nun unter anderem in fast ganz Europa einschließlich Russlands, in den USA und in Südafrika verbreitet. In den 1980er Jahren wurde bekannt, dass der Parasit für seine Entwicklung Tubifex tubifex, einen Ringelwurm aus der Gruppe der Tubificidae als Zwischenwirt benötigt. Seinen Endwirt, den Fisch, befällt er, indem er einen Polfaden aus einer Kapsel, die einer Nesselkapsel ähnelt, ausschleudert, der in die Haut des Wirtes eindringt. Myxobolus cerebralis war die erste Art der Myxozoa, die wissenschaftlich beschrieben wurde.
| Myxobolus cerebralis | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
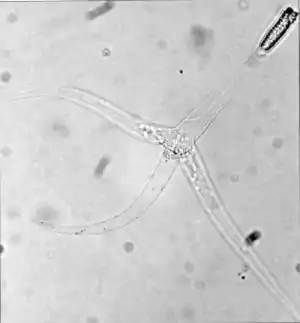
Myxobolus cerebralis | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Myxobolus cerebralis | ||||||||||||
| Hofer, 1903 |
Morphologie
M. cerebralis kommt in verschiedenen morphologischen Stadien vor, die ein Spektrum von einzelnen Zellen bis zu relativ komplexen Sporen aufweisen. Einige der Stadien sind heute noch nicht vollständig erforscht.
Triactinomyxon-Stadium
Das Triactinomyxon-Stadium ist das Stadium, in dem die Fische parasitiert werden. Es besteht aus einer langen Schale von etwa 150 Mikrometern Länge und drei langen Fortsätzen oder „Schwänzen“, die jeweils 200 Mikrometer lang sind. Am Ende der langen Schale befindet sich ein Sporoplasma-Paket mit 64 Keimzellen, die von weiteren Zellen umhüllt sind. Außerdem existieren drei Polkapseln, die jeweils ein aufgewickeltes Polfilament mit einer Länge von 170 bis 180 Mikrometer enthalten. Diese Filamente können sowohl in diesem als auch im Myxospora-Stadium abgeschossen werden und eine Öffnung im Gewebe des Fisches bilden, in die das Sporoplasma eindringt.
Sporoplasma-Stadium
Nach dem Kontakt mit dem Fisch und dem Abschuss der Polfilamente dringt das Sporoplasma, welches aus amöboiden Zellen besteht, in das Gewebe ein. Hier teilt es sich mitotisch und produziert auf diesem Weg weitere amöboide Zellen, welche weiter in das Gewebe bis in das Nervengewebe vordringen.
Myxospora-Stadium
Im Zellgewebe innerhalb des Wirtes entstehen linsenförmige Myxospora mit einem Durchmesser von etwa 10 Mikrometern, die aus jeweils sechs Zellen bestehen. Zwei dieser Zellen bilden Polkapseln, zwei weitere verändern sich in ein zweikerniges Sporoplasma und die beiden letzten bilden wieder eine Hülle darum, die als Valve bezeichnet wird. Diese Myxospora dringen in die Zwischenwirte, die Tubificiden, die sich von den Resten der gestorbenen Fische ernähren, ein.
Lebenszyklus
Myxobolus cerebralis ist ein Parasit mit Generationswechsel, der für seine Entwicklung zwei unterschiedliche Wirte benötigt: einen Forellenfisch und einen Tubificiden. Der bislang einzige bekannte Wurm, in dem sich Myxobolus cerebralis entwickeln kann, ist dabei Tubifex tubifex, wobei dieser eventuell keine einzelne Art, sondern einen Artenkomplex darstellt.
Die Würmer nehmen die Myxosporen auf, wenn sie sich von dem Gewebe der toten, infizierten Fische ernähren. Im Darm der Würmer verankern sich die Myxosporen durch das Polfilament in der Innenauskleidung. Hier öffnen sich die Valven und das zweikernige Zellgewebe verlässt die Schalen und dringt zwischen die Epithel- Zellen des Darmes ein. Die Keimzellen vermehren sich und produzieren weitere amöboide Zellen durch einen asexuellen Mechanismus, der als Merogonie bekannt ist. Durch diesen Prozess können durch einen einzigen aufgenommenen Parasiten die Zellzwischenräume von 10 hintereinanderliegenden Segmenten des Wurmes infiziert werden. Man vermutet, dass hier vollständige Zellen aus Zellteilen gebildet werden können.
Nach 60 bis 90 Tagen bilden sich sexuelle Stadien des Parasiten, die Sporen in Form von Pansporocyten bilden, die jeweils acht Triactinomyxon-Stadien beinhalten. Diese verlassen den Wurm durch dessen Darmausgang in das freie Wasser und können hier einen Fisch über die Haut infizieren. Betroffene Tubificiden können auf diesem Weg über ein Jahr lang adulte Triactinomyceten ausscheiden. Alternativ können auch Fische infiziert werden, die Tubificiden mit Parasiten fressen. In diesem Fall geschieht die Infektion durch die Darmwand. Dieser Vorgang dauert nur einige Sekunden, in denen der Fisch erst von den Polfilamenten penetriert und mit dem Sporoplasma infiziert wird. Innerhalb einiger Stunden beginnt die asexuelle Zellteilung des Sporoplasmas in weitere amöboide Zellen, die sich im Fischgewebe ausbreiten.
Im Fisch reproduzieren sich die Parasiten durch eine asexuelle Endogonie, bei der in alten Parasitenzellen neue Zellen entstehen. Das Endstadium im Fisch bildet das Myxospora-Stadium. Dieses wird erst wieder freigesetzt, wenn der Fisch gestorben ist und sich zersetzt oder wenn er gefressen wird. Nach neueren Erkenntnissen ist es allerdings vielleicht auch möglich, dass Myxosporen abgegeben werden, während der Fisch noch lebt. Die Myxosporen sind sehr resistent gegenüber Umwelteinflüssen. In Experimenten konnte nachgewiesen werden, dass die Sporen auch überleben, wenn sie für drei Monate bei −20 Grad Celsius eingefroren werden. Im Schlamm bleiben sie für etwa 5 Monate infektiös und auch eine Darmpassage bei Enten überstehen sie unbeschädigt. Die Triactinomyxone leben dagegen maximal 34 Tage, abhängig von der Temperatur.
Pathologie

Die Drehkrankheit tritt bei Jungfischen auf und verursacht eine Deformierung des Skeletts sowie eine Schädigung des Zentralen Nervensystems. Dadurch ist es den Fischen nicht mehr möglich, normal durch das Wasser zu schwimmen, stattdessen bewegen sie sich spiralig vorwärts. Sie werden leichter zur Beute für Räuber und können nur sehr erschwert jagen. Etwa 90 Prozent der befallenen Fische sterben als „Fingerlinge“ und die überlebenden Tiere bleiben sowohl im Skelett als auch im Gewebe deformiert. Die Parasiten leben weiter in den Fischen bis zu deren natürlichem Tod, nachdem sie wieder ins Freiwasser entlassen werden. Durch die hohe Mortalitätsrate gehört Myxobolus cerebralis zu den gefährlichsten Erregern und zugleich größten wirtschaftlichen Schädlingen der Fischwirtschaft. Eine Übertragung auf den Menschen ist nicht möglich.
Bislang wurde die Infektion mit Myxobolus cerebralis bei einer Reihe von Arten der Forellenfische nachgewiesen. Sicher ist die Infektion bei acht Arten der Gattung Salmo, vier Arten der Gattung Oncorhynchus, vier Arten der Saiblinge (Salvelinus) sowie der Europäischen Äsche (Thymallus thymallus) und dem Huchen (Hucho hucho). Eine Schädigung der Fische erfolgt durch das Eindringen der Parasiten und deren Ausbreitung im Gewebe sowie dadurch, dass sich die Parasiten vom Fischgewebe ernähren.
Äußerlich erkennbar kommt es zu einer Dunkelfärbung der Schwanzflosse und zu Skelettdeformierungen durch die Gewebezerstörung an den sich bildenden Knochen. Außerdem treten die beschriebenen Schwimmstörungen auf, die für die Drehkrankheit namensgebend sind und durch Beschädigungen des Rückenmarks und des Hirnstamms hervorgerufen werden. Die inneren Organe sind im Normalfall unbeschädigt, Gewebeschäden sind allerdings im Muskelgewebe erkennbar. Experimentell konnte nachgewiesen werden, dass das Immunsystem der Fische zwar eindringende Sporen bekämpft und auch abtöten kann, dass es jedoch keine Immunreaktion mehr gibt, sobald sich die Parasiten im Nervensystem etabliert haben. Die Immunreaktion ist dabei artabhängig.
Für die Wurmart Tubifex tubifex ist der Parasitenbefall nicht tödlich. Hier kommt es vor allem zu einer Beschädigung der Darmschleimhäute durch das Entlassen der Parasiten aus der Darmwand. Da dies in einem Wurm mehrere tausend Male passiert, kommt es auch zu einer Beeinträchtigung der Nahrungsaufnahme. Infizierte Würmer sind meistens kleiner und weniger stark gefärbt als uninfizierte Vertreter. Die Parasiten verlassen den Wurm nur bei Wassertemperaturen zwischen 10 und 15 °C, sodass Fische in kälteren oder wärmeren Gewässern nicht infiziert werden können. Entsprechend schwankt die Befallsrate auch jahreszeitlich.
Anfälligkeit
Die Anfälligkeit der Fische für den Parasitenbefall ist abhängig von ihrem Alter, ihrer Größe und natürlich von der Konzentration der Parasitensporen im Wasser. Außerdem spielt die Wassertemperatur eine große Rolle. Am anfälligsten sind Fische mit einem Alter von weniger als fünf Monaten, bei denen das Skelett noch nicht vollständig verknöchert ist. Dadurch werden die Tiere auch anfälliger für Deformationen. Auch die Artzugehörigkeit der Fische spielt eine bedeutende Rolle. In Untersuchungen konnte festgestellt werden, dass etwa Regenbogenforellen und Bachsaiblinge deutlich häufiger parasitiert sind als andere Forellenarten während der Königslachs, die Bachforelle und die Arktische Äsche kaum betroffen waren.
Die Bachforelle zeigt zudem kaum Symptome bei einem Befall mit dem Parasiten, weshalb man davon ausgeht, dass es sich hierbei um den Originalwirt handelt. Die großflächige Verbreitung des Parasiten ist demnach erst aufgetreten, als die Bachforelle mit eingeführten neuen Arten wie der Regenbogenforelle (Neozoen) in Berührung kam, die für die Erkrankung anfälliger sind.
Diagnose
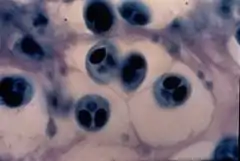
Eine starke bis sehr starke Infektion mit den Parasiten kann äußerlich bereits an den angesprochenen Deformationen sowie der Verhaltensänderung erkannt werden. Dies geschieht im Normalfall 35 bis 80 Tage nach der Infektion, allerdings kann auch eine Unterversorgung mit Tryptophan oder Ascorbinsäure ähnliche Auswirkungen haben. Eine eindeutige Diagnose ist also nur möglich, wenn Myxosporen im Gewebe der Fische nachgewiesen werden.
Bei starkem Befall ist dieser Nachweis bei einer Gewebeuntersuchung mit einem Mikroskop leicht möglich. Bei geringerem Befall wird eine Probe des Gewebes mit den Proteasen Pepsin und Trypsin anverdaut, um die Sporen erkennbar zu machen. Das Gewebe wird nachfolgend auf typische Kennzeichen der Myxobolus-cerebralis-Infektion untersucht. Auch eine serologische Untersuchung des Gewebes mit Hilfe von spezifischen Antikörpern ist möglich. Eine sichere Methode ist ebenfalls die Suche nach spezifischen Genen im Gewebe, wobei nach einer Polymerase-Kettenreaktion mit speziellen Markern nach einem bekannten Gen auf der 18S rRNA gesucht wird.
Diese Untersuchungen werden routinemäßig in verschiedenen Regionen durchgeführt, vor allem dort, wo der Parasit größeren Schaden anrichten kann. In Australien und Kanada, wo bislang noch keine Parasiten aufgetreten sind, werden die Tests eingesetzt, um frühzeitig einen Befall erkennen und bekämpfen zu können.
Ausbreitung
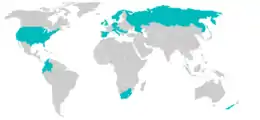
Während Myxobolus cerebralis lange Zeit nur ein eher harmloser Fischparasit der Bachforelle in Europa und einiger weniger weiterer Arten in Asien war, hat er sich durch die starke weltweite Ausbreitung der Regenbogenforelle ebenfalls verbreitet. Mit einer Erhöhung der Anzahl parasitierter Regenbogenforellen nahm auch die Anzahl der gebildeten Sporen zu, sodass die Gewässer stärker durchseucht wurden. Mit der sehr viel höheren Anzahl der Parasiten wurde nun auch der Infektionsdruck auf die weniger anfälligen Arten größer; auch diese konnten nun vom Parasiten erheblich dezimiert werden. In einigen Gebieten führte dies zu einem starken Rückgang der Fischpopulationen oder gar zu einem vollständigen Verschwinden einzelner Arten.
Ausbreitung in Europa
Wie bereits angesprochen stellt Europa den natürlichen Verbreitungsraum des Parasiten dar und hier heimische Arten sind an die Parasitierung durch Myxobolus cerebralis angepasst. Die Erkrankung läuft bei diesen Arten also im Regelfall sehr mild und ohne erkennbare Symptome ab. Erst durch die sehr anfällige Regenbogenforelle konnte sich der Parasit drastisch ausbreiten. Dabei gibt es nur sehr wenige wilde Populationen dieser Fische in europäischen Gewässern, vielmehr werden die Bestände regelmäßig durch Sportfischer ergänzt, da die Forellen beliebte Angeltiere sind. Als Reaktion auf die starke Parasitierung wurden in Europa entsprechend die Zuchtverhältnisse angepasst. Die Aufzucht der Jungfische erfolgt in Wasser, welches sicher sporenfrei ist und eine Freisetzung erfolgt erst, wenn die Verknöcherung des Skeletts vollkommen abgeschlossen ist und die Tiere entsprechend nicht mehr anfällig für die Parasiten sind.
Ausbreitung in Neuseeland
In Neuseeland wurden die ersten Parasiten im Jahr 1971 entdeckt, wobei sich die Funde nur auf Flüsse der Südinsel beschränkten und damit keine Nähe zu den ökonomisch wichtigen Fischbeständen und -zuchten bestand. Die heimischen Forellenfische waren zudem nicht anfällig für den Parasiten, sodass eine größere Ausbreitung ausblieb. Die Entdeckung führte jedoch zu starken Exporteinschränkungen von Fischen in den Nachbarstaat Australien, wo eine Einfuhr des Parasiten verhindert werden soll.
Ausbreitung in den USA
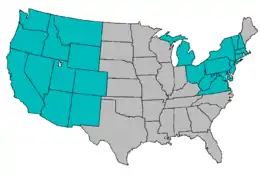
In Nordamerika wurde Myxobolus cerebralis erstmals 1956 in Pennsylvania entdeckt. Der Parasit war durch Fischimporte aus Europa eingeführt worden und verbreitet sich seitdem vor allem süd- und westwärts. Bis in die 1990er Jahre stellte die Drehkrankheit nur in den Fischzuchtanstalten der Regenbogenforellen ein Problem dar, welches zeitweise recht leicht unter Kontrolle gehalten werden konnte. Seitdem hat sich der Parasit jedoch in den natürlichen Gewässern einiger Gebiete vollständig etabliert und stellt vor allem in den Gebieten der Staaten an den Rocky Mountains (Colorado, Wyoming, Utah, Montana, Idaho, New Mexico) ein ernsthaftes Problem dar. In einigen Flüssen dieser Gebiete ging der Bestand der Forellen und Lachse um bis zu 90 Prozent zurück. Vor allem die Gebiete, in denen die Sportfischerei einen großen Anteil der Tourismuseinnahmen ausmacht, sind von der Drehkrankheit betroffen. So wird etwa der Schaden in Montana auf etwa 300 Millionen US-Dollar geschätzt. Hinzu kommt, dass einige der betroffenen Forellenarten mittlerweile vom Aussterben bedroht und in einigen Regionen vollständig verschwunden sind.
Bekämpfung
Um die Epidemie der Parasiten unter Kontrolle zu bekommen, haben einige Biologen begonnen, Wege zu suchen, mit denen die Sporen effektiv bekämpft werden können. Es soll vor allem ein Weg gefunden werden, wie man die Polkapseln dazu bringt, vorzeitig die Polfäden abzuschießen, sodass diese dann nicht mehr gegen Fische eingesetzt werden können. Bei Laborversuchen konnte festgestellt werden, dass die Sporen nur bei hohen Konzentrationen von Säuren oder Basen, Salzzugabe oder Elektrizität mit einem Abschuss reagierten. Weder Neurochemikalien, Stoffe, die bei Nesseltieren die Kapseln sensitivieren, noch der Schleim der Forellen, Betäubungsmittel oder tote Fische lösten die Kapseln aus. Auch wenn Stoffe gefunden werden, die eine Auslösung bewirken, stellt sich die Frage, ob diese auch im Freiland eingesetzt werden können.
Ein weiterer Ansatz nutzt die unterschiedliche Anfälligkeit von Fischen, die teilweise auch innerhalb der Arten sehr stark ausgeprägt ist. Mit Hilfe besonders resistenter Zuchtlinien soll die Anfälligkeit der Fische in den Gewässern reduziert werden.
Hinzu kommt, dass die Fischzucht dazu übergeht, keine potenziell verseuchten Sedimente mehr zu nutzen und so die Fischzuchtbecken frei von Parasiten zu halten, wie dies in Europa bereits erfolgreich durchgeführt werden konnte. Durch regelmäßige Desinfektionen des Substrates soll die Vermehrung der Tubificiden verringert oder komplett unterbunden werden. Auch vollständig substratfreie Becken, in denen sich keine Würmer halten können, sind im Gebrauch.
Die medikamentöse Behandlung von Fischen ist ebenfalls eine Option, die jedoch nicht bei Wildfischpopulationen angewendet werden kann. Zur Auswahl stehen hier Furazolidon, Furoxon, Benomyl, Fumagillin, Proguanil und Clamoxyquin. In Experimenten konnte durch die Zufütterung mit Fumagillin eine Reduktion des Parasitenbefalls von ursprünglich 73 bis 90 Prozent auf 10 bis 20 Prozent bei Regenbogenforellen erreicht werden.
Taxonomie
Der wissenschaftliche Name cerebralis entstammt der frühen Vorstellung, dass der beschriebene Parasit vor allem das Zentrale Nervensystem und das Gehirn (Cerebrum) des Wirtes befällt. Nachdem man feststellte, dass dies nicht der Fall ist und der Parasit stattdessen im Gewebe und dort vor allem am Skelett zu finden ist, sollte er in Myxobolus chondrophagus umbenannt werden. Dies ist jedoch aufgrund der zoologischen Nomenklaturregeln nicht möglich. Hinzu kam, dass man feststellte, dass es sich bei Organismen, die vorher als Triactinomyxon dubium und T. gyrosalmo in einer eigenen Klasse Actinosporea geführt wurden, um Stadien des Myxobolus cerebralis handelt (Triactinomyxon-Stadium), die entsprechend ebenfalls diesen Namen erhielten.
Literatur
- Andree, K.B., MacConnell, E. and Hedrick, R.P. (1998): A nested polymerase chain reaction for the detection of genomic DNA of Myxobolus cerebralis in rainbow trout Oncorhynchus mykiss, Diseases of Aquatic Organisms 34, 145–54
- Bartholomew, J.L. and Reno, P.W. (2002): The history and dissemination of whirling disease, American Fisheries Society Symposium 29; 3–24
- Bergersen, E.P., and Anderson, D.E. (1997): The distribution and spread of Myxobolus cerebralis in the United States, Fisheries 22 (8); 6–7
- El-Matbouli, M., and Hoffmann, R.W. (1991): Effects of freezing, aging, and passage through the alimentary canal of predatory animals on the viability of Myxobolus cerebralis spores, Journal of Aquatic Animal Health 3; 260–262
- El-Matbouli, M., and Hoffmann, R.W. (1998): Light and electron microscopic studies on the chronological development of Myxobolus cerebralis to the Actinosporean stage in Tubifex Tubifes, International Journal For Parasitology 28; 195–217
- El-Matbouli, M., Hoffman, R.W., Shoel, H., McDowell, T. S., & Hedrick, R.P. (1999): Whirling disease: host specificity and interaction between the actinosporean stage of Myxobolus cerebralis and rainbow trout (Oncorhynchus mykiss) cartilage, Diseases of Aquatic Organisms 35; 1–12
- Gilbert, M. A. & Granath, W.O. Jr. (2003): Whirling disease and salmonid fish: life cycle, biology, and disease, Journal of Parasitology 89; 658–667
- Halliday, M.M. (1976): The Biology Of Myxosoma cerebralis: The Causative Organism Of Whirling Disease Of Salmonids, Journal of Fish Biology 9; 339–357
- Hedrick, R. P. & El–Matbouli, M. (2002): Recent advances with taxonomy, life cycle, and development of Myxobolus cerebralis in the fish and oligochaete hosts, American Fisheries Society Symposium 29; 45–53
- Hoffmann, G. (1962): Whirling Disease Of Trout, U.S. Department Of The Interior, Fishery Leaflet 508; 1–3
- Lom, J. & Dyková, I. (1992): Protozoan Parasites of Fishes, Elsevier, Amsterdam (ISBN 0444894349)
- Markiw, M.E. (1989): Portals of entry for salmonid whirling disease in rainbow trout, Diseases of Aquatic Organisms 6; 6–10
- Markiw, M.E. (1992): Salmonid Whirling didease, Fish and Wildlife Leaflet 17, Volltext (Memento vom 10. Juli 2004 im Internet Archive)
- Markiw, M.E. (1992): Experimentally induced whirling disease. II. Determination of longevity of the infective triactinomyxon stage of Myxobolus cerebralis by vital staining, Journal of Aquatic Animal Health 4; 44–47
- Nehring, R.B. (1996): Whirling Disease In Feral Trout Populations In Colorado, in E.P. Bergersen And B.A.Knoph (Hrsg.): Proceedings: Whirling Disease Workshop––where Do We Go From Here?, Colorado Cooperative Fish And Wildlife Research Unit, Fort Collins
- Nehring, R. B. Thompson, K. G. Taurman, K. A. & Shuler, D.L. (2002): Laboratory studies indicating that living brown trout Salmo trutta expel viable Myxobolus cerebralis myxospores, American Fisheries Society Symposium 29; 125–134
- Nickum, D. (1999): Whirling Disease in the United States: A Summary of Progress in Research and Management, Trout Unlimited.
- Tennyson, J. Anacker, T. & Higgins, S. (1997): Scientific breakthrough helps combat trout disease. U.S. Fish and Wildlife Service Whirling Disease Foundation News Release.
- Vincent, E.R. (1996): Whirling Disease—the Montana Experience, Madison River, in, E.P. Bergersen And B.A.Knoph (Hrsg.): Proceedings: Whirling Disease Workshop—where Do We Go From Here?, Colorado Cooperative Fish And Wildlife Research Unit, Fort Collins
- Vincent, E. R. (2002): Relative susceptibility of various salmonids to whirling disease with emphasis on rainbow and cutthroat trout, American Fisheries Society Symposium 29; 109–115
- Wagner, E. J. Cannon, Q. Smith, M. Hillyard, R. & Arndt, R. (2002): Extrusion of Polar Filaments of the Myxobolus cerebralis Triactinomyxon by salts, electricity, and other agents, American Fisheries Society Symposium 29; 61–76
- Wisconsin Department of Agriculture, Trade and Consumer Protection, Division of Animal Health (October 2001): Fish Health Advisory: Whirling Disease in Trout. (PDF)
Weblinks
- Report der World Trade Organization (WTO) zu den Einfuhrbeschränkungen von Forellen nach Australien (englisch, DOC-Format; 1,0 MB)
- The Whirling Disease Foundation (englisch)