Methylnitrit
Methylnitrit, ist ein Ester der salpetrigen Säure mit Methanol und ist bei Raumtemperatur ein farbloses, hochentzündliches und giftiges Gas.[1] Es ist das am einfachsten aufgebaute Alkylnitrit.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
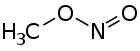 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Methylnitrit | |||||||||||||||
| Andere Namen |
Salpetrigsäuremethylester | |||||||||||||||
| Summenformel | CH3NO2 | |||||||||||||||
| Kurzbeschreibung |
farbloses Gas[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 61,04 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte |
0,991 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
−6,42 °C[1] | |||||||||||||||
| Löslichkeit |
sehr schwer löslich[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−66,1 kJ/mol[3] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Darstellung
Methylnitrit entsteht beim Einwirken von kalter, verdünnter Schwefelsäure auf eine Wasser-Methanol-Lösung von Natriumnitrit.[4][5] Methylnitrit (im Gemisch mit Nitromethan) kann auch durch Umsetzung von Silbernitrit mit Iodmethan hergestellt werden.[6]
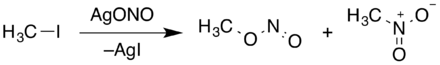
Eine weitere Herstellmöglichkeit besteht durch die Zugabe eines Gemisches aus Nitrosylschwefelsäure und Schwefelsäure in wässriges Methanol.[7]
Eigenschaften
Methylnitrit hat einen Schmelzpunkt von −40,2 °C und einen Siedepunkt von −6,42 °C.[1] In der älteren Literatur sind diese mit −16 °C (Smp.) und −12 °C (Sdp.) angegeben.[4] Die Dampfdruckfunktion ergibt sich nach August entsprechend lg(P) = −A/T+B (P in Torr, T in K) mit A = 1365 und B = 8,102 im Temperaturbereich von 154 K bis 225 K.[7] Aus der Dampfdruckfunktion lässt sich eine molare Verdampfungsenthalpie von 26,15 kJ·mol−1 ableiten.[7] Wie bei Alkylnitriten üblich entsteht bei der Einwirkung von nascierendem Wasserstoff auf die Verbindung Methanol, Ammoniak und Wasser.[8]
Struktur
Bei Raumtemperatur besteht Methylnitrit aus einem Gemisch aus dem cis- und dem trans-Konformeren. Das cis-Konformere ist mit 3,13 kJ·mol−1 stabiler als die trans-Form. Die Energie-Barriere für die innere Rotation beträgt 45,3 kJ·mol−1.[9]
 cis-Methylnitrit
cis-Methylnitrit trans-Methylnitrit
trans-Methylnitrit
Verwendung
Für Nitrosierungen in der organischen Synthese z. B. zur Darstellung von Isonitrosopropiophenon.[10]
Einzelnachweise
- Eintrag zu Methylnitrit in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Dezember 2020. (JavaScript erforderlich)
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-20.
- L. F. Fieser, M. Fieser: Organischen Chemie. 2. Auflage, Verlag Chemie, 1975.
- Tarte, P.: Rotational Isomerism as a General Property of Alkyl Nitrites in J. Chem. Phys., 1952, 20, S. 1570–1575. doi:10.1063/1.1700218.
- Donald L. Pavia, Gary M. Lampman, George S. Kriz: Organic Chemistry, Band 2. Thompson Custom Publishing, Mason, Ohio 2004, ISBN 0-03-014813-8.
- Rook, F.L.: Preparation, Vapor Pressure, and Infrared Spectrum of Methyl Nitrite in J. Chem. Eng. Data 27 (1982) S. 72–73, doi:10.1021/je00027a022.
- Beyer / Walter: Lehrbuch der Organischen Chemie, 22. Auflage, S. Hirzel Verlag, Stuttgart 1991, S. 154.
- B.J. Van der Veken, R. Maas, G.A. Guirgis, H.D. Stidham, T.G. Sheehan, J.R. Durig: Infrared spectrum, ab initio calculations, barriers to internal rotation and structural parameters for methyl nitrite. In: J. Phys. Chem.. 94, Nr. 10, 1990, S. 4029–4039. doi:10.1021/j100373a028.
- Walter H. Hartung, Frank Crossley: Isonitrosopropiophenone In: Organic Syntheses. 16, 1936, S. 44, doi:10.15227/orgsyn.016.0044; Coll. Vol. 2, 1943, S. 363 (PDF).