Methyl-5-amino-4-oxopentanoat
Methyl-5-amino-4-oxopentanoat (MAOP), Internationaler Freiname Methyl(5-amino-4-oxopentanoat)-hydrochlorid,[2] ist ein Arzneistoff zur photodynamischen Therapie (PDT) von oberflächlichen und knotigen Basaliomen und aktinischen Keratosen.
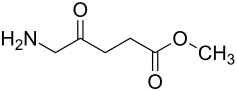
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Methyl-5-amino-4-oxopentanoat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C6H11NO3 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code |
L01XD03 | |||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 145,16 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Beschreibung
MAOP ist der Methylester von 5-Aminolävulinsäure. MAOP reichert sich bevorzugt in Hautkrebs- und präkanzerösen Zellen an. Als Prodrug wird es durch Esterasen in den Zellen zu 5-Aminolävulinsäure (5-ALA) verstoffwechselt. In den Zellen entsteht durch die katalytische Einwirkung von δ-Aminolävulinsäure-Dehydratase aus zwei Molekülen 5-ALA zunächst Porphobilinogen (PBG). Aus vier Molekülen PBG wird dann über drei weitere Zwischenstufen letztlich Protoporphyrin IX, der eigentliche Photosensibilisator für die photodynamische Therapie, gebildet.
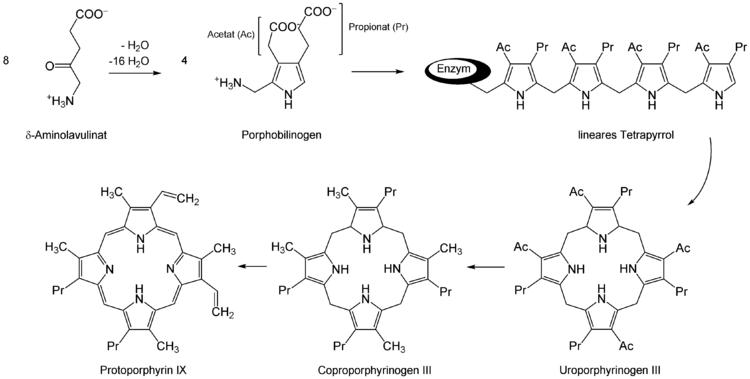
Protoporphyrin IX macht die Zellen empfindlich gegen Licht. Durch die Bestrahlung mit Licht mit einer Wellenlänge von ca. 630 nm werden freie Radikale und reaktive Sauerstoffspezies erzeugt, die die entarteten Zellen über die Auslösung der Apoptose abtöten.[3] Die üblicherweise verabreichte Lichtdosis liegt im Bereich von 37[4] bis 75 J/cm².[5] Bestrahlt wird etwa elf Minuten, so dass sich eine Leistung im Größenbereich von 50 mW/cm² ergibt.[4]
Für die Aufnahme von MAOP und 5-ALA in gesunde sowie krankhafte Hautzellen, aber auch Nervenzellen der sensorischen Wurzelganglien sind der gamma-Aminobuttersäure (GABA)-Transporter GAT-3 oder Aminosäuretransporter hauptverantwortlich.[6][7] Hingegen ist eine passive Diffusion der sehr hydrophilen Moleküle über die Zellmembran für die Anreicherung innerhalb der Zelle unbedeutend. Protoporphyrin IX reichert sich in verschiedenen Zelltypen schneller nach Zugabe von 5-ALA als nach MAOP an.[7][8][9][10][11][12][13] Vermutlich erfolgt die bei MAOP nötige Spaltung des Methylrests durch zelluläre Esterasen eher langsam. Nach einer für die photodynamische Therapie relevanten Einwirkzeit in Hautkrebszellen wurde bei Zugabe von 5-ALA eine im Vergleich zu MAOP fast doppelt so intensive Anreicherung von Protoporphyrin IX festgestellt.[7] Protoporphyrin IX aus 5-ALA reicherte sich zudem selektiver in Hautkrebszellen gegenüber gesunden Zellen an.[7]
Methyl-5-amino-4-oxopentanoat ist zurzeit das einzige Arzneimittel, das zur photodynamischen Therapie des oberflächlichen und knotigen Basalioms und von aktinischen Keratosen zugelassen ist.
Verabreichung und Anwendung
MAOP wird als Hautcreme etwa 1 mm stark auf die zu behandelnde Stelle aufgetragen. Dabei wird über das betroffene Areal hinaus ein seitlicher Sicherheitsbereich von 10 mm ebenfalls mit Creme versehen.[4] Die Creme enthält 16 % MAOP in Form seines Hydrochlorids. Nach einer Einwirkzeit von etwa drei Stunden beginnt die eigentliche photodynamische Therapie. Vor der Bestrahlung wird meist noch ein Schmerzmittel, beispielsweise Metamizol,[4] oral verabreicht und ein lokal anästhesierendes Gel aufgetragen. Die lokale Bestrahlung und die erhöhte Anreicherung in entarteten Zellen sorgen dafür, dass das umliegende gesunde Gewebe weitgehend geschont wird. Die Behandlung ist meist ambulant und kann nach etwa drei Monaten wiederholt werden.[4] Die Wiederholung erhöht die Heilungschancen deutlich.[5]
Nebenwirkungen
Bis 80 % der Patienten zeigen lokale phototoxische Reaktionen, die sich vor allem in Form von Schmerzen, Ödemen und Erythemem äußert.[14] Die Ödeme und Erytheme sollten nicht mit Corticosteroiden behandelt werden, da diese Entzündungsreaktionen wesentlicher Bestandteil des Heilungsprozesses sind.
Eine Reihe von retrospektiven Studien und Berichten kam zu unterschiedlichen Ergebnissen bezüglich der durch PDT mit MAOP bzw. 5-ALA hervorgerufenen Schmerzintensität, wobei jedoch keine klare Tendenz zugunsten eines der beiden Wirkstoffe erkennbar wurde. In der einzigen direkt vergleichenden, kontrolliert ausgeführten Phase III-Studie traten die bei der photodynamischen Therapie mit MAOP und 5-ALA hervorgerufenen Schmerzen mit derselben Häufigkeit auf und wurden von den Patienten als gleich intensiv empfunden.[14]
Entwicklungsgeschichte
MAOP wurde von dem norwegischen Unternehmen Photocure entwickelt. Galderma, damals ein Gemeinschaftsunternehmen von Nestlé und L’Oréal, erwarb 2001 eine exklusive Lizenz für die Herstellung und den Vertrieb von MAOP.[15]
Weiterführende Literatur
- C. B. Warren, L. J. Karai, A. Vidimos, E. V. Maytin: Pain associated with aminolevulinic acid-photodynamic therapy of skin disease. In: Journal of the American Academy of Dermatology. Band 61, Nummer 6, Dezember 2009, S. 1033–1043. doi:10.1016/j.jaad.2009.03.048. PMID 19925929. (Review).
- B. Ortiz-Policarpio, H. Lui: Methyl aminolevulinate-PDT for actinic keratoses and superficial nonmelanoma skin cancers. In: Skin therapy letter. Band 14, Nummer 6, Jul–Aug 2009, S. 1–3. PMID 19609473. (Review).
- P. Lehmann: Methyl aminolaevulinate-photodynamic therapy: a review of clinical trials in the treatment of actinic keratoses and nonmelanoma skin cancer. In: British Journal of Dermatology. Band 156, Nummer 5, Mai 2007, S. 793–801. doi:10.1111/j.1365-2133.2007.07833.x. PMID 17419691. (Review).
- R. M. Szeimies: Methyl aminolevulinate-photodynamic therapy for basal cell carcinoma. In: Dermatologic Clinics. Band 25, Nummer 1, Januar 2007, S. 89–94. doi:10.1016/j.det.2006.09.008. PMID 17126746. (Review).
- C. A. Morton: Methyl aminolevulinate: actinic keratoses and Bowen's disease. In: Dermatologic Clinics. Band 25, Nummer 1, Januar 2007, S. 81–87. doi:10.1016/j.det.2006.09.009. PMID 17126745. (Review).
- P. Foley: Clinical efficacy of methyl aminolaevulinate photodynamic therapy in basal cell carcinoma and solar keratosis. In: Australasian Journal of Dermatology. Band 46, Suppl 3, Februar 2005, S. S8–S10. PMID 15859301. (Review).
- C. A. Morton: Methyl aminolevulinate (Metvix) photodynamic therapy - practical pearls. In: Journal of Dermatological Treatment. Band 14, Suppl 3, 2003, S. 23–26. PMID 14522638. (Review).
- P. Foley: Clinical efficacy of methyl aminolevulinate (Metvix) photodynamic therapy. In: Journal of Dermatological Treatment. Band 14, Suppl 3, 2003, S. 15–22. PMID 14522637. (Review).
- S. B. Brown: The role of light in the treatment of non-melanoma skin cancer using methyl aminolevulinate. In: Journal of Dermatological Treatment. Band 14, Suppl 3, 2003, S. 11–14. PMID 14522636. (Review).
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Verordnung über die Verschreibungspflicht von Arzneimitteln (Arzneimittelverschreibungsverordnung - AMVV). Vom 21. Dezember 2005.
- A. Casas, A. Batlle: Aminolevulinic acid derivatives and liposome delivery as strategies for improving 5-aminolevulinic acid-mediated photodynamic therapy. In: Current Medicinal Chemistry. Band 13, Nummer 10, 2006, S. 1157–1168. PMID 16719777. (Review).
- H. Weisser, D. Meyer-Rogge, E. Meyer-Rogge: Erste Erfahrungen im niedergelassenen Bereich mit neuem topischen Photosensibilisator MAOP bei aktinischen Keratosen und Basaliomen. (PDF; 697 kB). In: Akt Dermatol. Band 30, 2004, S. 306–311. doi:10.1055/s-2004-825849.
- M. A. Siddiqui, C. M. Perry, L. J. Scott: Topical methyl aminolevulinate. In: American Journal of Clinical Dermatology. Band 5, Nummer 2, 2004, S. 127–137. PMID 15109276. (Review).
- B. Novak, R. Schulten, H. Lübbert: δ-Aminolevulinic acid and its methyl ester induce the formation of Protoporphyrin IX in cultured sensory neurones. In: Naunyn Schmiedebergs Arch Pharmacol. 384(6), Dez 2011, S. 583–602. doi:10.1007/s00210-011-0683-1. Epub 2011 Sep 25. PMID 21947250
- R. Schulten, B. Novak, B. Schmitz, H. Lübbert: Comparison of the uptake of 5-aminolevulinic acid and its methyl ester in keratinocytes and skin. In: Naunyn Schmiedebergs Arch Pharmacol. 385(10), Okt 2012, S. 969–979. doi:10.1007/s00210-012-0777-4. Epub 2012 Jul 17. PMID 22801976
- R. Washbrook, H. Fukuda, A. Battle, P. Riley: Stimulation of tetrapyrrole synthesis in mammalian epithelial cells in culture by exposure to aminolaevulinic acid. In: Br J Cancer. 75, 1997, S. 381–387.
- P. Uehlinger, M. Zellweger, G. Wagnieres, L. Juillerat-Jeanneret, H. van den Berg, N. Lange: 5-Aminolevulinic acid and its derivatives: physical chemical properties and protoporphyrin IX formation in cultured cells. In: J Photochem Photobiol B. 54, 2000, S. 72–80.
- J. M. Gaullier, K. Berg, Q. Peng, H. Anholt, P. K. Selbo, L. W. Ma, J. Moan: Use of 5-aminolevulinic acid esters to improve photodynamic therapy on cells in culture. In: Cancer Res. 57, 1997, S. 1481–1486.
- R. G. Tunstall, A. A. Barnett, J. Schofield, J. Griffiths, D. I. Vernon, S. B. Brown, D. J. Roberts: Porphyrin accumulation induced by 5-aminolaevulinic acid esters in tumour cells growing in vitro and in vivo. In: Br J Cancer. 87, 2002, S. 246–250.
- L. Rodriguez, A. Batlle, G. Di Venosa, S. Battah, P. Dobbin, A.J. Macrobert, A. Casas: Mechanisms of 5-aminolevulinic acid ester uptake in mammalian cells. In: Br J Pharmacol. 147, 2006, S. 825–833.
- J. B. Lee, J. Y. Choi, J. S. Chun, S. J Yun, S. C. Lee, J. Oh, H. R. Park: Relationship of protoporphyrin IX synthesis to photodynamic effects by 5-aminolaevulinic acid and its esters on various cell lines derived from the skin. In: Br J Dermatol. 159, 2008, S. 61–67.
- T. Dirschka, P. Radny, R. Dominicus, H. Mensing, H. Brüning, L. Jenne, L. Karl, M. Sebastian, C. Oster-Schmidt, W. Klövekorn, U. Reinhold, M. Tanner, D. Gröne, M. Deichmann, M. Simon, F. Hübinger, G. Hofbauer, G. Krähn-Senftleben, F. Borrosch, K. Reich, C. Berking, P. Wolf, P. Lehmann, M. Moers-Carpi, H. Hönigsmann, K. Wernicke-Panten, S. Hahn, G. Pabst, D. Voss, M. Foguet, B. Schmitz, H. Lübbert, R. M. Szeimies; AK-CT002 Study Group; AK-CT003 Study Group: Photodynamic therapy with BF-200 ALA for the treatment of actinic keratosis: results of a multicentre, randomized, observer-blind phase III study in comparison with a registered methyl-5-aminolaevulinate cream and placebo. In: Br J Dermatol. 168(4), 2013, S. 825–836. PMID 21910711
- galderma.com: Our History. (Memento vom 3. September 2011 im Internet Archive) Abgerufen am 4. August 2011.