Mellitsäure
Mellitsäure (Benzolhexacarbonsäure, auch Graphitsäure) ist eine Säure, die erstmals im Jahr 1799 von Martin Heinrich Klaproth im Mineral Mellit (Honigstein) entdeckt wurde, dem Aluminiumsalz der Säure.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
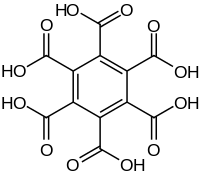 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Mellitsäure | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C12H6O12 | |||||||||||||||||||||
| Kurzbeschreibung |
seidenglänzende Nadeln[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 342,16 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert | ||||||||||||||||||||||
| Löslichkeit |
leicht löslich in Wasser und Ethanol[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Darstellung
Mellitsäure kann durch Erwärmen von Mellit mit Ammoniumcarbonat hergestellt werden. Mit einem Überschuss von Ammoniak werden die Aluminiumionen als Hydroxid ausgefällt und abgetrennt; es verbleibt das Ammoniumsalz der Mellitsäure. Die Säure kann auch durch Oxidation von reinem Kohlenstoff oder Hexamethylbenzol hergestellt werden, in der Kälte durch alkalisches Kaliumpermanganat oder durch heiße konzentrierte Salpetersäure.[4]
Eigenschaften
Mellitsäure kristallisiert in feinen seidigen Nadeln und ist in Wasser und Ethanol löslich. Es ist eine sehr stabile Verbindung: Chlor, konzentrierte Salpetersäure und Iodwasserstoff haben keine zersetzende Wirkung. Mellitsäure zersetzt sich durch trockene Destillation in Kohlenstoffdioxid, Wasser und Pyromellitsäuredianhydrid, C10H2O6; in Gegenwart von Kalk erfolgt vollständige Zersetzung in Kohlenstoffdioxid und Benzol. Eine Umsetzung der Säure mit überschüssigem Phosphorpentachlorid bildet das Säurechlorid, das in Nadeln kristallisiert und bei 190 °C schmilzt.
Die hohe Stabilität der Mellitsäuresalze und ihre Eigenschaft als Endprodukt der Oxidation von polycyclischen aromatischen Kohlenwasserstoffen, die im Sonnensystem vorkommen, machen sie zu möglichen Kandidaten für organische Substanzen im Marsboden.[5]
Siehe auch
Mellitsäureanhydrid, das Anhydrid der Mellitsäure, das formal auch als ein Oxid des Kohlenstoffs C12O9 (Dodecakohlenstoffnonaoxid) aufgefasst werden kann.
Literatur
- Henry Enfield Roscoe: A Treatise on Chemistry: The chemistry of the hydrocarbons and their derivatives, or Organic chemistry. Appleton, 1889, S. 373 (eingeschränkte Vorschau in der Google-Buchsuche).
Einzelnachweise
- Eintrag zu Mellit(h)säure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. Juni 2014.
- CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- Datenblatt Mellitic acid bei Sigma-Aldrich, abgerufen am 9. April 2011 (PDF).
- Reaktionen des Kohlenstoffs bei webelements.com
- S. A. Benner, K. G. Devine, L. N. Matveeva, D. H. Powell: "The missing organic molecules on Mars", in: Proceedings of the National Academy of Sciences, 2000, 97 (6), S. 2425–2430; doi:10.1073/pnas.040539497; PMID 10706606.
