Hexamethylbenzol
Hexamethylbenzol (Mellitol, Melliten) ist ein mit sechs Methylgruppen substituiertes Benzol und damit ein aromatischer Kohlenwasserstoff.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
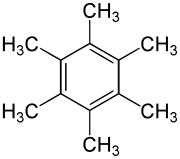 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Hexamethylbenzol | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C12H18 | |||||||||||||||
| Kurzbeschreibung |
orthorhombische Prismen oder Nadeln[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 162,28 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,042 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
263,4 °C[1] | |||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser, löslich in Ethanol, Ether, Aceton, Benzol, Essigsäure und Chloroform[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Geschichte und Eigenschaften
Im Jahr 1880 beobachteten J. Le Bel und W. H. Greene, dass bei der Umsetzung von Methanol über geschmolzenem Zinkchlorid auch Hexamethylbenzol gebildet wurde.[4]
Die Reaktion wurde interpretiert als Dehydrocyclisierung von Ethen zu Benzol unter anschließender Friedel-Crafts-Alkylierung durch Methylchlorid.
Hexamethylbenzol ist ein Feststoff, der orthorhombische Prismen oder Nadeln bildet.[1] Der Schmelzpunkt liegt bei 165,5 °C und ist damit der höchste der methylsubstituierten Benzole.
Der Trivialname Mellitol leitet sich aus der Mellitsäure (Benzolhexacarbonsäure) ab, die wiederum aus Mellit (Honigstein) isoliert wurde. In gleicher Weise leitet sich daraus der Trivialname des 1,2,3-Trimethylbenzols (Hemellitol, Hemi-Mellitol) ab. Die Silbe Hemi- kennzeichnet hier die Hälfte an Substituenten.

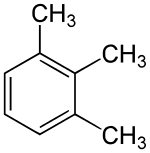
Mellitol (Hexamethylbenzol) Hemellitol
Im Jahr 1929 bewies Kathleen Lonsdale erstmals die Form des Hexamethylbenzols und zeigte somit, dass der Benzolring hexagonal und eben ist.[5] Im Gegensatz dazu weist das Hexamethylbenzol-Dikation eine pentagonal-pyramidale Struktur auf, bei dem das apikale sechsfach koordinierte Kohlenstoffatom sowohl an eine Methylgruppe (Bindungslänge 1,479(3) Å) sowie die fünf basalen Kohlenstoffatome gebunden ist (Bindungslängen 1,694(2)–1,715(3) Å).[6]
Darstellung
Zur Darstellung wird eine Lösung von Phenol in Methanol über einen längeren Zeitraum auf einen aktivierten Aluminiumoxid-Katalysator von 530 °C getropft.[7][8]
Verwendung
Weil es elektronenreich ist, kann Hexamethylbenzol als Ligand in der metallorganischen Chemie verwendet werden. Es findet Verwendung in zahlreichen metallorganischen Synthesen, z. B. mit Titan, Chrom, Cobalt, Rhodium und Rhenium.[9][10][11][12] Zwei weitere Beispiele aus der Organoruthenium-Chemie sind die Sandwichkomplexe Ru(ɳ4-C6(CH3)6)(ɳ6-C6(CH3)6) und das Dikation [Ru(ɳ6-C6(CH3)6)2]2+.[13]
Hexamethylbenzol wird ferner als Lösungsmittel für die 3He-NMR-Spektroskopie verwendet.[14]
Literatur
- H. W. Earhart, Andrew P. Komin: Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc., 2000, ISBN 978-0-471-23896-6, Kapitel Polymethylbenzenes, doi:10.1002/0471238961.1615122505011808.a01.
Einzelnachweise
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-280.
- L. O. Brockway, J. M. Robertson: "The Crystal Structure of Hexamethylbenzene and the Length of the Methyl Group Bond to Aromatic Carbon Atoms", in: J. Chem. Soc., 1939, S. 1324–1332; doi:10.1039/JR9390001324.
- Datenblatt Hexamethylbenzol bei Sigma-Aldrich, abgerufen am 17. Januar 2017 (PDF).
- Clarence D. Chang: "Hydrocarbons from Methanol", in: Catal. Rev. Sci. Eng., 1983, 25 (1), S. 1–118; Abstract.
- Kathleen Lonsdale: "The Structure of the Benzene Ring in C6 (CH3)6", in: Proceedings of the Royal Society, 1929, 123A, S. 494–515; doi:10.1098/rspa.1929.0081.
- Moritz Malischewski, K. Seppelt: Die Molekülstruktur des pentagonal-pyramidalen Hexamethylbenzol-Dikations C6(CH3)62+ im Kristall. In: Angewandte Chemie. Band 129, Nr. 1, 2017, S. 374–376, doi:10.1002/ange.201608795.
- N. M. Cullinane, S. J. Chard, C. W. C. Dawkins: Hexamethylbenzene In: Organic Syntheses. 35, 1955, S. 73, doi:10.15227/orgsyn.035.0073; Coll. Vol. 4, 1963, S. 520 (PDF).
- Phillip S. Landis, Werner O. Haag: "Formation of Hexamethylbenzene from Phenol and Methanol", in: The Journal of Organic Chemistry, 1963, 28 (2), S. 585–585; doi:10.1021/jo01037a517.
- H. H. Zeiss, W. Herwig: "ACETYLENIC π-COMPLEXES OF CHROMIUM IN ORGANIC SYNTHESIS", in: J. Am. Chem. Soc., 1958, 80 (11), S. 2913–2913; doi:10.1021/ja01544a091.
- B. Franzus, P. J. Canterino, R. A. Wickliffe: "TITANIUM TETRACHLORIDE-TRIALKYLALUMINUM COMPLEX – A CYCLIZING CATALYST FOR ACETYLENIC COMPOUNDS", in: J. Am. Chem. Soc., 1959, 81 (6), S. 1514–1514; doi:10.1021/ja01515a061.
- Ernst Otto Fischer, Hans Hasso Lindner: "Über Aromatenkomplexe von Metallen. LXXVI. Di-hexamethylbenzol-metall-π-komplexe des ein- und zweiwertigen Kobalts und Rhodiums", in: Journal of Organometallic Chemistry, 1964, 1 (4), S. 307–317; doi:10.1016/S0022-328X(00)80056-X.
- Ernst Otto Fischer, Manfred Wilhelm Schmidt: "Über Aromatenkomplexe von Metallen, XCI. Über monomeres und dimeres Bis-hexamethylbenzol-rhenium", in: Chemische Berichte, 1966, 99 (7), S. 2206–2212; doi:10.1002/cber.19660990719.
- M. A. Bennett, T. N. Huang, T. W. Matheson, A. K. Smith: "(η6-Hexamethylbenzene)Ruthenium Complexes", in: Inorganic Syntheses, 1982, 21, S. 74–78; doi:10.1002/9780470132524.ch16.
- M. Saunders, H. A. Jimenez-Vazquez, A. Khong: "NMR of 3He Dissolved in Organic Solids", in: J. Phys. Chem., 1996, 100 (39), S. 15968–15971; doi:10.1021/jp9617783.
Weblinks
- Eintrag zu Hexamethylbenzol. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD, abgerufen am 19. Dezember 2012.