Magnesiumpermanganat
Magnesiumpermanganat ist eine anorganische chemische Verbindung des Magnesiums aus der Gruppe der Permanganate.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
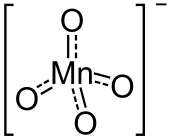 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Magnesiumpermanganat | |||||||||||||||
| Summenformel | Mg(MnO4)2 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 262,18 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
2,18 g·cm−3 (25 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
löslich in Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Magnesiumpermanganat-Hexahydrat wurde von E. Mitserlich und H. Aschoff mittels der Umsetzung von Silberpermanganat mit Magnesiumchlorid oder Bariumpermanganat mit Magnesiumsulfat hergestellt. Ausgehend von Silberpermanganat und Magnesiumchlorid führt eine langsame Kristallisation und Trocknung zum Tetrahydrat. Das Anhydrat kann durch thermische Dehydration des Hexahydrates gewonnen werden.[2]
Eigenschaften
Magnesiumpermanganat-Hexahydrat ist ein blauschwarzer Feststoff.[3] Er zersetzt sich ab 130 °C unter Sauerstoffentwicklung in einem autokatalytischen Zersetzungsprozess. Das Tetrahydrat zersetzt sich ab 150 °C. Die Kristalle sind in Tri- und Tetrachlorkohlenstoff, Benzol, Toluol, Nitrobenzolether, Ligroin und Kohlenstoffdisulfid praktisch unlöslich, aber in Pyridin und Eisessig löslich. In Wasser löst es sich auf und dissoziiert vollständig in verdünnten Lösungen. Es oxidiert eine Reihe von organischen Verbindungen und reagiert sofort (in einigen Fällen mit Feuer) mit üblichen Lösungsmitteln wie THF, Ethanol, Methanol, t-Butanol, Aceton und Essigsäure.[2]
Verwendung
Magnesiumpermanganat wird in verschiedenen Zweigen der Industrie und Technologie verwendet, z. B. als Holzimprägniermittel, als Additiv in Tabakfiltern, als Katalysator bei der Luftoxidation von Toluol zu Benzoesäure und in der Proteomforschung.[2][4]
Einzelnachweise
- Datenblatt Magnesium permanganate hydrate bei Sigma-Aldrich, abgerufen am 10. Januar 2017 (PDF).
- Laszlo Kotai, Istvan Gacs, Istvan E. Sajo, Pradeep K. Sharma, Kalyan K. Banerji: ChemInform Abstract: Beliefs and Facts in Permanganate Chemistry - An Overview on the Synthesis and the Reactivity of Simple and Complex Permanganates. In: ChemInform. 42, 2011, S. no, doi:10.1002/chin.201113233.
- William M. Haynes: CRC Handbook of Chemistry and Physics, 97th Edition. CRC Press, 2016, ISBN 978-1-4987-5429-3, S. 72 (eingeschränkte Vorschau in der Google-Buchsuche).
- Richard C. Ropp: Encyclopedia of the Alkaline Earth Compounds. Newnes, 2012, ISBN 0-444-59553-8, S. 875 (eingeschränkte Vorschau in der Google-Buchsuche).

