Bariumpermanganat
Bariumpermanganat ist eine anorganische chemische Verbindung des Bariums aus der Gruppe der Permanganate.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
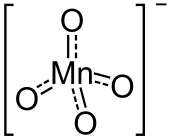 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Bariumpermanganat | |||||||||||||||
| Andere Namen |
Bariummanganat(VII) | |||||||||||||||
| Summenformel | Ba(MnO4)2 | |||||||||||||||
| Kurzbeschreibung |
braunvioletter bis schwarzer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 375,20 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Dichte |
3,77 g·cm−3[2] | |||||||||||||||
| Löslichkeit |
625 g/l bei 20 °C[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Bariumpermanganat kann durch Reaktion von Bariummanganat mit Kohlendioxid in Wasser oder mit Schwefelsäure gewonnen werden.[2]
Bariumpermanganat kann auch aus Silberpermanganat und Bariumchlorid hergestellt werden. Hochreines Bariumpermanganat kann durch Reaktion von Kaliumpermanganat mit Aluminiumsulfat hergestellt werden, wobei das gebildete Aluminiumpermanganat mit einer stöchiometrischer Menge an Bariumhydroxid umgesetzt wird.[5]
Eigenschaften
Bariumpermanganat ist ein braunvioletter bis schwarzer Feststoff[1], der wenig löslich in Wasser ist. Es ist ein starkes Oxidationsmittel und zersetzt sich bei hohen Temperaturen über 280 °C zu Bariummanganat.[6]
Es ist thermisch stabil bis zu 180 °C und zersetzt sich in zwei Stufen zwischen 180–350 und 500–700 °C. Die Zersetzung erfolgt schnell ab Temperaturen von 200–220 °C, ist exotherm und die Aktivierungsenergie beträgt 113 kJ/mol. Die Zersetzung kann wie folgt beschrieben werden.[5]
Untersuchungen zeigten, dass die Zersetzung bereits langsam bei 160 °C beginnt und diese Temperatur durch Einwirkung von UV-Licht oder Röntgenstrahlung (Aktivierung) weiter sinkt.[7] Für die Zersetzungstemperatur und den Zersetzungsmechanismus spielen Kristalldefekte und Verunreinigungen eine Rolle. Die Verbindung kommt nicht als Hydrat vor, nur in einer Matrix von Bariumperchlorat-Trihydrat ist ein Trihydrat als Mischkristall bekannt.[5]
Bariumpermanganat hat eine orthorhombische Kristallstruktur mit der Raumgruppe Fddd (Raumgruppen-Nr. 70) (a = 14,749, b = 11,896 , c = 7,414 Å, Z = 8). Die durchschnittlichen O-Mn-Abstände sind 1,74 und 1,61 Å.[5]
Verwendung
Durch Umsetzung von Bariumpermanganat mit Sulfaten lassen sich Permanganate der verschiedensten Metalle darstellen.[2]
Einzelnachweise
- Richard P. Pohanish: Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens. William Andrew, 2011, ISBN 1-4377-7870-4, S. 323 (eingeschränkte Vorschau in der Google-Buchsuche).
- Georg Brauer: Handbuch der präparativen anorganischen Chemie. 3., umgearb. Auflage. Band III. Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1585.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Inorganic Compounds, S. 4-50.
- Eintrag zu Bariumpermanganat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Juli 2016. (JavaScript erforderlich)
- Laszlo Kotai, Istvan Gacs, Istvan E. Sajo, Pradeep K. Sharma, Kalyan K. Banerji: ChemInform Abstract: Beliefs and Facts in Permanganate Chemistry - An Overview on the Synthesis and the Reactivity of Simple and Complex Permanganates. In: ChemInform. 42, 2011, S. no, doi:10.1002/chin.201113233.
- Richard C. Ropp: Encyclopedia of the Alkaline Earth Compounds. Newnes, 2012, ISBN 0-444-59553-8, S. 895 (eingeschränkte Vorschau in der Google-Buchsuche).
- E. G. Prout, P. J. Herley: THE THERMAL DECOMPOSITION OF BARIUM PERMANGANATE. In: The Journal of Physical Chemistry. 65, 1961, S. 208, doi:10.1021/j100820a005.

