Macitentan
Macitentan (Handelsname Opsumit; Hersteller Actelion Pharmaceuticals Ltd) ist ein Arzneistoff aus der Gruppe der dualen Endothelin-Rezeptor-Antagonisten (ERA). Er wird in der Behandlung eines erhöhten Blutdrucks im Lungenkreislauf (pulmonale arterielle Hypertonie) eingesetzt.[4]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
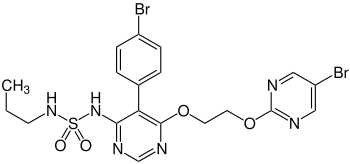 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Macitentan | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C19H20Br2N6O4S | |||||||||||||||
| Kurzbeschreibung |
beige-weißes Pulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code |
C02KX04 | |||||||||||||||
| Wirkmechanismus |
Dualer Endothelin-Rezeptor-Antagonist | |||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 588,37 g·mol−1 | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Klinische Angaben
Anwendungsgebiete (Indikationen)
Macitentan ist ein neuartiger dualer Endothelin-Rezeptor-Antagonist (ERA) mit einer guten Gewebedurchdringung und der Eigenschaft, langanhaltend an Rezeptoren binden zu können. Macitentan wurde von der Schweizer Firma Actelion Pharmaceuticals zur Behandlung der pulmonal arteriellen Hypertonie (PAH) entwickelt. Weitere Indikationsgebiete sind zurzeit in der Erforschung. Pathophysiologisch liegen der PAH Veränderungen an den Lungengefäßen zugrunde. In diesem Prozess spielt Endothelin-1 (ET-1), das überwiegend von den Endothelzellen in das Gewebe sezerniert wird, eine Schlüsselrolle.
Macitentan ist seit dem 20. Januar 2013 in Deutschland zugelassen. Von der US-amerikanischen Behörde FDA wurde die Zulassung des Wirkstoffs bereits im Oktober 2013 erteilt. In vorklinischen Studien konnte gezeigt werden, dass Macitentan die Bindung von ET-1 an die ET-Rezeptoren in verschiedenen Zellsystemen, Organen und Tiermodellen hemmt. Dabei konnte für Macitentan eine stärkere Wirksamkeit als für Bosentan und Ambrisentan, zwei bereits seit längerem zugelassene Endothelin-Rezeptor-Inhibitoren, demonstriert werden. Auf dieser Grundlage wurde Macitentan zur Behandlung der PAH in klinischen Studien weiter untersucht.[2]
Die Wirksamkeit und Sicherheit von Macitentan bei PAH wurde in der SERAPHIN-Studie (SERAPHIN = Study with Endothelin Receptor Antagonist in Pulmonary Arterial Hypertension to improve clinical outcome) untersucht.[5] SERAPHIN ist eine ereignisgesteuerte Langzeitstudie mit dem kombinierten Endpunkt Morbidität/Mortalität. Mit 742 Teilnehmern und einer Studiendauer von 3,5 Jahren ist SERAPHIN die bislang größte und längste abgeschlossene PAH-Studie, für die zudem erstmals ein prognostisch relevanter und robuster primärer Studienendpunkt definiert wurde: Die Zeit bis zum Auftreten des ersten Morbiditäts-/Mortalitäts-Ereignisses. Die Studienteilnehmer wurden in einem Verhältnis von 1:1:1 randomisiert und erhielten einmal täglich entweder 3 mg Macitentan, 10 mg Macitentan oder Placebo. PAH-spezifische Begleitmedikationen waren erlaubt, und rund zwei Drittel der Patienten nahmen bei Studieneintritt bereits weitere PAH-spezifische Medikamente, vornehmlich Phosphodiesterase-5-Inhibitoren wie z. B. Sildenafil ein.
Als Ergebnis zeigte sich:
- Macitentan in der von der EMA und FDA zugelassenen Dosierung von 10 mg verringert signifikant das Risiko für das Auftreten eines Morbiditäts-/Mortalitäts-Ereignisses um 45 %. Die Risikoreduktion konnte deutlich für Therapie-naive Patienten als auch für Patienten mit PAH-spezifischer Vortherapie gezeigt werden.
- Macitentan hat einen signifikant positiven Effekt auf die Hospitalisierungsrate (sekundärer Endpunkt): Unter Macitentantherapie in einer Dosierung von 10 mg verringerte sich das Risiko für Hospitalisierung gegenüber Placebo um ca. 50 Prozent (p < 0,001).
- Macitentan wurde in der SERAPHIN-Studie gut vertragen, Nebenwirkungen wie Erhöhung der Leberwerte und erhöhte Ödemraten waren nicht häufiger als in der Placebogruppe. Im Vergleich zur Kontrollgruppe traten bei den mit Macitentan behandelten Patienten häufiger Nasopharyngitis, Kopfschmerzen und Anämie auf. Jeweils ein Patient aus jeder Gruppe, auch aus der Placebogruppe, brach die Behandlung aufgrund einer Anämie ab.
Art und Dauer der Anwendung
Der Wirkstoff wird oral appliziert. In der Klinischen Studie der Phase III wurde mit Dosierungen von 3 mg bzw. 10 mg einmal täglich gearbeitet. Erhältlich ist es in der Dosierung von 10 mg pro Tablette, was gleichzeitig der Maximaldosierung entspricht.[6]
Wechselwirkungen mit anderen Medikamenten
Da der Wirkstoff über die Leberenzyme des Typs CYP3A4 verstoffwechselt wird, sollten Medikamente die auf dieses Enzym induzierend oder inhibierend wirken, nicht gleichzeitig angewendet werden. Macitentan selbst hat jedoch keinerlei enzyminduzierende oder -inhibierende Effekte.[6]
Anwendung während Schwangerschaft und Stillzeit
Der Wirkstoff ist in der Schwangerschaft kontraindiziert, da er zu Schäden in der Entwicklung des Feten führen kann. Daher ist vor, sowie einen Monat nach Behandlungsbeginn ein negativer Schwangerschaftstest vonnöten, danach dauerhafte Maßnahmen zur Kontrazeption.[6]
Unerwünschte Wirkungen (Nebenwirkungen)
Macitentan hat keinen Einfluss auf die Gallensalz-Exportpumpe. Dadurch scheint Macitentan nicht zu einer Erhöhung der Leberwerte zu führen, wie sie bei anderen Endothelin-Rezeptor-Antagonisten als unerwünschte Wirkung vorkommen kann. In vitro und in vivo hat Macitentan ein gutes Arzneimittelwechselwirkungs-Profil bewiesen. Bei den klinischen Studien zu Opsumit® waren die häufigsten Nebenwirkungen Anämie, Infektionen der oberen Atemwege, Bronchitis, Kopfschmerzen, Influenza und Harnwegsinfektionen. Die Anwendung anderer ERAs wurde außerdem mit einer Erhöhung der Aminotransaminasen, Hepatotoxizität und Leberversagen assoziiert. Daher sollten bei der Behandlung mit Opsumit® Leberenzymtests durchgeführt werden und bei Einsetzen von Leberversagen die Behandlung abgebrochen werden. Auch wurde bei wirkverwandten Substanzen eine Hemmung der Spermatogenese beobachtet. Die ebenfalls bei anderen Wirkstoffen dieser Arzneistoffgruppe auftretende Anämie und die Senkung des Hämatokrits wurden auch in den klinischen Studien von Opsumit beobachtet. Sie traten jedoch früh auf und stabilisierten sich im Verlauf der Behandlung und selten war eine Transfusion notwendig. Daher wird Patienten mit einer schwerwiegenden Anämie von der Einnahme des Medikaments abgeraten.[6]
Frühe Nutzenbewertung nach § 35a SGB V
Wie bei Überschreitung der 50-Millionen-€-Umsatzgrenze für Orphan-Arzneimittel im Arzneimittelmarktneuordnungsgesetz vorgesehen, hat das IQWiG 2017 eine Dossierbewertung vorgelegt. Demnach ist ein Zusatznutzen gegenüber der vom Gemeinsamen Bundesausschuss (G-BA) festgelegten zweckmäßigen Vergleichstherapie nicht belegt.[7] Der Gemeinsame Bundesausschuss (G-BA) hat sich dem Bewertungsergebnis angeschlossen.[8]
Pharmakologische Eigenschaften
Wirkungsmechanismus (Pharmakodynamik)
Als dualer Endothelin-Rezeptor-Antagonist blockiert Macitentan sowohl ETA- als auch ETB-Rezeptoren. Natürlicher Hauptligand dieser Rezeptoren ist Endothelin-1, der als starker Vasokonstriktor fungiert. Durch Blockade dieser Gq-Protein-gekoppelten Rezeptoren wird der Ca2+-Einstrom in die glatten Muskelzellen und somit die Vasokonstriktion der Blutgefäße im Lungenkreislauf verhindert. Dies führt zu einer Erniedrigung des Gefäßwiderstands, was wiederum indirekt eine Abnahme des Blutdrucks zur Folge hat.[9]
Aufnahme und Verteilung im Körper (Pharmakokinetik)
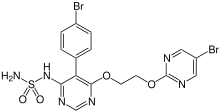
Macitentan wird durch oxidative Depropylierung in seinen aktiven Metaboliten ACT-132577 überführt. Beide Stoffe werden in Form ihrer Hydrolyseprodukte zu 2/3 über den Urin und zu 1/3 über die Faeces ausgeschieden.[10] Macitentan kann trotz seiner Unlöslichkeit in Wasser gut im Blut transportiert werden, da es eine Plasmaeiweiß-Bindung von über 99 % aufweist.[9] Eine Schlüsselrolle in der Pathogenese der PAH spielt der Botenstoff Endothelin, ein Protein, das im Endothel vorkommt. Endothelin ist einer der stärksten bekannten körpereigenen Vasokonstriktoren (100-mal höhere vasokonstriktorische Potenz als Noradrenalin, 10-mal höhere als Angiotensin II). Bei Patienten mit PAH finden sich erhöhte Plasma-Konzentrationen an Endothelin, die mit der Schwere der Erkrankung korrelieren. Eine erhöhte Konzentration ist mit einer erhöhten Mortalität assoziiert. Die schädlichen Endothelin-Wirkungen werden dabei über zwei verschiedene Rezeptor-Subtypen (ETA und ETB) vermittelt, deren Expression und Verteilungsmuster unter pathophysiologischen Bedingungen verändert sein können und zur kompensatorischen Funktionsübernahme des jeweils anderen Rezeptorsubtyps führen kann („Rezeptor-Crosstalk“). Macitentan verdrängt als Antagonist das Endothelin-1 und wirkt damit den schädigenden ET-1-Effekten – Vasokonstriktion, Inflammation und Remodelling der Lungengefäße – entgegen.
Langanhaltende Rezeptorbindung
Die pharmakologische Aktivität und letztlich die klinische Wirksamkeit von Rezeptor-Antagonisten wie Macitentan können in vivo durch die Bindungskinetik beeinflusst werden. Die Assoziations- und Dissoziationsraten von Macitentan, den ET-Rezeptor-betreffend, wurden in vitro untersucht und mit Bosentan und Ambrisentan verglichen. Im Ergebnis zeigte Macitentan eine verstärkte Affinität gegenüber den ET-Rezeptoren im Vergleich zu den bereits zugelassenen Endothelin-Rezeptor-Antagonisten, eine langanhaltende Rezeptor-Bindung und anhaltende pharmakologische Aktivität.
Verbesserte Gewebedurchdringung
Macitentan zeigt optimierte physikalisch-chemische Eigenschaften. So weist das Macitentan-Molekül einen hohen nicht-ionisierten Anteil auf, der es ermöglicht, lipophile Zellmembranen besser und schneller zu durchdringen. Dadurch konnte die Gewebegängigkeit von Macitentan erhöht werden, so dass seine Wirkung gezielt dort, wo sie benötigt wird – im Gewebe der Lungengefäße – zum Einsatz kommen kann.[11][12][13][14][15]
Toxikologie
Macitentan wurde oral in Mäusen beiden Geschlechts in 75- bis 140-facher der beim Menschen angewandten Dosis und bei Ratten beiden Geschlechts bei 8,3- bis 42-fachen Dosis auf Kanzerogenität getestet. Es ließ sich hierbei keine krebserzeugende Wirkung feststellen.
Auch im Bereich der Mutagenität fielen die Tests ähnlich aus. Hierbei wurde die Standard-Batterie an Tests durchgeführt. Dazu wurden in vitro- und in vivo-Tests, bakterielle Rückmutationstests, ein Test auf Genmutationen in Maus-Lymphomzellen, ein Chromosomenaberration Test in menschlichen Lymphozyten und ein in vivo-Mikrokerntest an Ratten durchgeführt.
Behandlungen von jugendlichen Ratten in den postnatalen Tagen 4 bis 114 führten zu verringerter Körpergewichtszunahme und an den Hoden zur Tubulusatrophie bei Expositionen, die dem 7-fachen der menschlichen Exposition entsprechen. In Studien zur chronischen Toxizität bei Expositionen von mehr als dem 7- und 23-fachen der menschlichen Dosis bei Ratten und Hunden wurden reversible Tubulus-Dilatation im Bereich der Hoden beobachtet.
Nach 2 Jahren Behandlung wurde des Weiteren Tubulusatrophie bei Ratten gesehen, die über diese Zeit dem 4-fachen der humanen Dosis ausgesetzt waren. Macitentan hatte keinen Einfluss auf männliche oder weibliche Fertilität im Bereich vom 19- bis 44-fachen der Exposition beim Menschen. Auch hatte es keinen Einfluss auf die Spermienzahl, Motilität und Morphologie bei männlichen Ratten. In Mäusen wurden keine Veränderungen der Hoden nach der zweijährigen Behandlung festgestellt. Auch hier war die Fertilität nicht betroffen.
Bei Hunden wurde bei Behandlung mit Macitentan ein verringerter Blutdruck festgestellt. Dabei wurden die Tiere mit etwa der gleichen Dosis wie Menschen behandelt. Beim 17-fachen der Humanexposition trat eine Verdickung der Intima der Koronararterien nach 4–39 Wochen der Behandlung auf. Aufgrund der Spezies-spezifischen Empfindlichkeit und dem Dosisunterschied zur Anwendung am Menschen wird diese Feststellung aber für den Menschen als nicht relevant angesehen.[9]
In Langzeitstudien an Mäusen, Ratten und Hunden, die mit der 12- bis 116-fachen Dosis behandelt wurden, gab es keine Erkenntnisse, die bei Dauertherapie auf Schädigung der Leber hinweisen.
In der Literatur finden sich keine Daten zu einer Dosis, die bei Macitentan bei den Versuchstieren zum Tod geführt hat.[9]
Chemie
Synthese
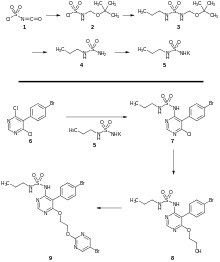
Die Synthese beginnt mit der Reaktion von Chlorsulfonylisocyanat (1) tert-Butanol. Dabei entsteht ein durch BOC geschütztes Aminosulfonylchlorid (2). Mit n-Propylamin entsteht unter Salzsäureabspaltung ein BOC-geschütztes Sulfamid (3). Die BOC-Schutzgruppe wird abgespalten und das gebildete Sulfamid (4) durch Kalium-tert-butanolat in das Kalium-Salz (5) umgewandelt. Kalium-tert-butanolat fungiert hier als sehr starke Base zur Deprotonierung. Dieses Kalium-Sulfamid-Salz reagiert mit dem nucleophilen Substituenten am Heteroaromat des Dichlorpyrimidinderivats (6) unter KCl-Abspaltung zu einem Monochlorpyrimidin-Zwischenprodukt (7). Durch Versetzen mit Ethylenglycol wird die Ethylenglycol-Seitenkette generiert (8). Mit 2-Chlor-5-brom-pyrimidin entsteht unter HCl-Abspaltung in einer SN1-Reaktion Macitentan (9).[2]
Eigenschaften
Macitentan besitzt ein basisches Zentrum, was auch zur Reaktivitätsanalytik herangezogen werden kann. Dieses befindet sich am von der Sulfon-Gruppe abgewandten Stickstoffatom des Pyrimidin-Rings. Dieser Stickstoff kann leicht protoniert werden und erhält somit eine positive Ladung.
Identitätsprüfung und Gehaltsbestimmung
Zur qualitativen Analyse wäre beispielsweise eine Beilsteinprobe auf organische Halogenverbindungen möglich, in der die beiden Bromatome an den peripheren Ringen nachgewiesen werden. Alternativ könnten die Halogene auch nach vorangegangenem Lassaigne-Aufschluss elementaranalytisch als Silberbromid ausgefällt und beispielsweise gravimetrisch bestimmt werden.
Siehe auch
Handelsnamen
- Opsumit
Einzelnachweise
- Lancrix Chemicals: Macitentan| CAS-Nummer: 441798-33-0 | Lancrix Chemicals, abgerufen am 2. März 2014.
- Martin H. Bolli, Christoph Boss, Christoph Binkert, Stephan Buchmann, Daniel Bur, Patrick Hess, Marc Iglarz, Solange Meyer, Josiane Rein, Markus Rey, Alexander Treiber, Martine Clozel, Walter Fischli, Thomas Weller: The Discovery of N-[5-(4-Bromophenyl)-6-[2-[(5-bromo-2-pyrimidinyl)oxy]ethoxy]-4-pyrimidinyl]-N′-propylsulfamide (Macitentan), an Orally Active, Potent Dual Endothelin Receptor Antagonist. In: Journal of Medicinal Chemistry. Band 55, 2012, S. 7849–7861, doi:10.1021/jm3009103.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Patentanmeldung WO2002053557: Novel sulfamides and their use as endothelin receptor antagonists. Angemeldet am 18. Dezember 2000, veröffentlicht am 11. Juli 2002, Anmelder: Actelion, Erfinder: Martin Bolli, Christoph Boss, Martine Clozel, Walter Fischli et al..
- T. Pulido u. a.: Macitentan and Morbidity and Mortality in Pulmonary Arterial Hypertension. In: N Engl J Med. Band 369, 2013, S. 809–818.
- Actelion-Website: macitentan (Memento vom 13. Januar 2014 im Internet Archive), abgerufen am Donnerstag, 9. Januar 2014.
- IQWiG-Berichte – Nr. 476 Macitentan (pulmonal arterielle Hypertonie) – Nutzenbewertung gemäß § 35a SGB V, abgerufen am 20. August 2018.
- Beschluss des Gemeinsamen Bundesausschusses vom 06.04.2017 über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII – Macitentan (Neubewertung eines Orphan – Drugs nach Überschreitung der 50 Mio. Euro Grenze), abgerufen am 20. August 2018.
- U.S. National Library of Medicine (NLM):OPSUMIT (macitentan) tablet, section-12.2, abgerufen am Donnerstag, 9. Januar 2014.
- Verteilung im Körper laut informahealthcare.com: Shirin Bruderer, Gerard Hopfgartner, Michael Seiberling, Janine Wank, Patricia N. Sidharta, Alexander Treiber, Jasper Dingemanse: Absorption, distribution, metabolism, and excretion of macitentan, a dual endothelin receptor antagonist, in humans. In: Xenobiotica. Band 42, 2012, S. 901–910, doi:10.3109/00498254.2012.664665, abgerufen am Donnerstag, 9. Januar 2014.
- J. Gatfield, C. Mueller Grandjean, T. Sasse, M. Clozel, O. Nayler: Slow Receptor Dissociation Kinetics Differentiate Macitentan from Other Endothelin Receptor Antagonists in Pulmonary Arterial Smooth Muscle Cells. In: PLOS ONE. Band 7, Nr. 10, 2012, S. e47662. doi:10.1371/journal.pone.0047662.
- M. Iglarz u. a.: Pharmacology of macitentan, an orally active tissue-targeting dual endothelin receptor antagonist. In: J PharmacolExpTher. Band 327, Nr. 3, 2008, S. 736–745.
- P. N. Sidharta u. a.: Macitentan: Entry-into-humans study with a new endothelin receptor antagonist. In: Eur J ClinPharmacol. Band 67, Nr. 10, 2011, S. 977–984.
- S. Bruderer u. a.: Absorption, distribution, metabolism, and excretion of macitentan, a dual endothelin receptor antagonist, in humans. In: Xenobiotica. Band 42, Nr. 9, Sep 2012, S. 901–910.
- S. Bruderer u. a.: Effect of cyclosporine A and rifampin on the pharmacokinetics of macitentan, a tissue-targeting dual endothelin receptor antagonist. In: AAPS J. Band 14, Nr. 1, 2012, S. 68–78.