Linagliptin
Linagliptin (BI-1356, Markenname: Trajenta®) ist ein Arzneistoff zur peroralen Behandlung von Typ 2-Diabetes. Im August 2011 erteilte die Europäische Kommission die Zulassung für das von dem pharmazeutischen Unternehmen Boehringer Ingelheim entwickelte Medikament.[2] Linagliptin ist ein Wirkstoff aus der Gruppe der Dipeptidylpeptidase-4-Inhibitoren. Diese hemmen das Enzym Dipeptidylpeptidase 4 (DPP-4).
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
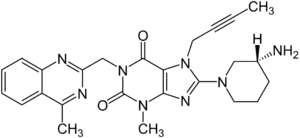 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Linagliptin | |||||||||||||||
| Andere Namen |
8-[(3R)-3-Aminopiperidin-1-yl]-7-(but-2-in-1-yl)-3-methyl-1-[(4-methylchinazolin-2-yl)methyl]-3,7-dihydro-1H-purin-2,6-dion (IUPAC) | |||||||||||||||
| Summenformel | C25H26N8O2 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code |
A10BH05 | |||||||||||||||
| Wirkstoffklasse |
Antidiabetika | |||||||||||||||
| Wirkmechanismus |
DPP4-Inhibitor | |||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 472,54 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Pharmakologie
Pharmakodynamik (Wirkweise)
Linagliptin ist ein Inhibitor des Dipeptylpeptidase-Isoenzyms DPP-4, welches er kompetitiv und selektiv gegenüber anderen Isoenzymen, wie die Dipeptylpeptidasen DPP-8 und DPP-9, hemmt. Als Dipeptylpeptidase-4-Inhibitor hemmt es den Abbau des Inkretin-Hormons Glucagon-like-peptide 1 (GLP-1). Im Vergleich zu den 2008 bereits kommerziell genutzten Gliptinen Sitagliptin, Saxagliptin und Vildagliptin zeichnete sich Linagliptin in Zellkulturen sowie in Tierversuchen an Ratten durch eine höhere Wirkpotenz und eine längere Wirkdauer aus.[3]
Pharmakokinetik
Viele pharmakokinetische Eigenschaften von Linagliptin, wie die Clearance und das Verteilungsvolumen, sind nichtlinear und dosisabhängig. Die orale Bioverfügbarkeit von 10 mg Linagliptin liegt bei 30 %.[4] Im Organismus wird Linagliptin von seinem Zielprotein, der Dipeptylpeptidase-4, gebunden und nur zu einem geringen Prozentsatz verstoffwechselt.[5] Die Eliminationshalbwertszeit ist dosisunabhängig und liegt zwischen 125 und 140 Stunden.[4] Die Ausscheidung erfolgt überwiegend über den Magen-Darm-Trakt. Etwa 5 % der oral gegebenen Dosis werden renal eliminiert. Damit ist Linagliptin der einzige der bis 2011 zugelassenen DPP4-Hemmer, der unabhängig von der Nierenfunktion gegeben werden kann.
Zulassung / Gesundheitspolitik
Im August 2011 wurde Linagliptin von der Europäischen Kommission zugelassen. Die Tablette ist in einer Dosis von 5 mg zugelassen als Monotherapie beim Diabetes mellitus Typ 2, wenn für Metformin eine Unverträglichkeit besteht oder Metformin aufgrund einer Niereninsuffizienz kontraindiziert ist. Bei Bedarf ist auch die Kombination von Linagliptin mit Metformin, sowie die Kombination von Linagliptin mit Metformin und Sulfonylharnstoff zugelassen.[6]
In Deutschland wurde im Zusammenhang mit der frühen Nutzenbewertung durch das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) das Medikament vom Hersteller Boehringer Ingelheim und seinem Allianzpartner Eli Lilly noch nicht auf den Markt gebracht.[7] Für die frühe Nutzenbewertung reichte der Hersteller im Jahr 2011 nicht die Vergleiche mit den Standardtherapien mit Metformin und Sulfonylharnstoffen ein, sondern verglich Linagliptin mit anderen Gliptinen. Das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen konnte für Linagliptin daher keinen Zusatznutzen gegenüber den Standardtherapien mit Metformin und Sulfonylharnstoffen bescheinigen.[8] Der Gemeinsame Bundesausschuss räumte dem Hersteller die Möglichkeit ein, zu einem späteren Zeitpunkt eine erneute Nutzenbewertung des Wirkstoffs anhand vollständiger Bewertungsunterlagen zu veranlassen.[9] Nach erneuter Nutzenbewertung im Dezember 2012 kam das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) zu dem Ergebnis: „Auch bei der Bewertung des neuen Dossiers lässt sich kein Zusatznutzen des Wirkstoffs gegenüber der zweckmäßigen Vergleichstherapie feststellen. Denn der Hersteller hat keine relevanten Studien vorgelegt.“[10] Dementsprechend hat der Gemeinsame Bundesausschuss im Februar 2013 aus formalen Gründen beschlossen, dass für Linagliptin sowohl in der Monotherapie als auch Zweifachkombinationstherapie (Linagliptin + Metformin) ein Zusatznutzen nicht belegt sei.[11][12]
Literatur
- C. F. Deacon, J. J. Holst: Linagliptin, a xanthine-based dipeptidyl peptidase-4 inhibitor with an unusual profile for the treatment of type 2 diabetes. In: Expert Opin Investig Drugs. Band 19, Nr. 1, Januar 2010, S. 133–140, doi:10.1517/13543780903463862, PMID 19947894.
- A. Tiwari: Linagliptin, a dipeptidyl peptidase-4 inhibitor for the treatment of type 2 diabetes. In: Curr Opin Investig Drugs. Band 10, Nr. 10, Oktober 2009, S. 1091–1104, PMID 19777398.
- T. Forst, B. Uhlig-Laske, A. Ring, A. Ritzhaupt, U. Graefe-Mody, K. A. Dugi: The oral DPP-4 inhibitor linagliptin significantly lowers HbA1c after 4 weeks of treatment in patients with type 2 diabetes mellitus. In: Diabetes, Obesity and Metabolism. 13, 2011, S. 542, PMID 21352464, doi:10.1111/j.1463-1326.2011.01386.x.
Weblinks
- Eintrag zu Linagliptin in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Linagliptin
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- dpa: Boehringer verbucht weiteren Etappensieg. In: Handelsblatt. 26. August 2011.
- L. Thomas, M. Eckhardt, E. Langkopf, M. Tadayyon, F. Himmelsbach, M. Mark: (R)-8-(3-amino-piperidin-1-yl)-7-but-2-ynyl-3-methyl-1-(4-methyl-quinazolin-2-ylmethyl)-3,7-dihydro-purine-2,6-dione (BI 1356), a novel xanthine-based dipeptidyl peptidase 4 inhibitor, has a superior potency and longer duration of action compared with other dipeptidyl peptidase-4 inhibitors. In: J. Pharmacol. Exp. Ther. Band 325, Nr. 1, April 2008, S. 175–182, doi:10.1124/jpet.107.135723, PMID 18223196.
- S. Retlich, V. Duval, A. Ring u. a.: Pharmacokinetics and pharmacodynamics of single rising intravenous doses (0.5 mg-10 mg) and determination of absolute bioavailability of the dipeptidyl peptidase-4 inhibitor linagliptin (BI 1356) in healthy male subjects. In: Clin Pharmacokinet. Band 49, Nr. 12, Dezember 2010, S. 829–840, doi:10.2165/11536620-000000000-00000, PMID 21053992.
- S. Blech, E. Ludwig-Schwellinger, E. U. Gräfe-Mody, B. Withopf, K. Wagner: The metabolism and disposition of the oral dipeptidyl peptidase-4 inhibitor, linagliptin, in humans. In: Drug Metab. Dispos. Band 38, Nr. 4, April 2010, S. 667–678, doi:10.1124/dmd.109.031476, PMID 20086031.
- (EPAR Zusammenfassung für die Öffentlichkeit) (PDF; 120 kB) Zulassungsmitteilung Trajenta – Linagliptin, EMA, (detailliertere Informationen) abgerufen am 29. Juli 2012 (englisch).
- AMNOG bremst: Kein Linagliptin in Deutschland, Pharmazeutische Zeitung online, 5. September 2011.
- Zusatznutzen von Linagliptin ist nicht belegt (PDF; 24 kB), Pressemitteilung IQWiG vom 2. Januar 2012.
- Frühe Nutzenbewertung: G-BA trifft sechs weitere Entscheidungen, Pressemitteilung G-BA vom 29. März 2012.
- Linagliptin: Erneut keine Belege für Zusatznutzen, Pressemitteilung IQWiG vom 3. Dezember 2012.
- Beschluss des Gemeinsamen Bundesausschusses (PDF; 306 kB), Beschlusstext G-BA vom 21. Februar 2013.
- Klage gegen Nutzenbewertung: Pharmaindustrie demontiert den Kostendämpfer für Pillen In: Der Spiegel Online, 22. Februar 2013.