Lefamulin
Lefamulin ist ein antibiotisch wirksamer Arzneistoff aus der Gruppe der Pleuromutiline. In den USA ist es seit August 2019, in der EU seit Juli 2020[2] als Xenleta zur Behandlung ambulant erworbener Lungenentzündungen (Community-Acquired Bacterial Pneumonia, CABP) zugelassen.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
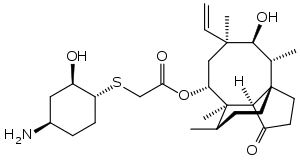 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Lefamulin | |||||||||||||||
| Andere Namen |
(3aS,4R,5S,6S,8R,9R,9aR,10R)-6-Ethenyl-5-hydroxy-4,6,9,10-tetramethyl-1-oxodecahydro-3a,9-propanocyclopenta[8]annulen-8-yl[((1R,2R,4R)-4-amino-2-hydroxycyclohexyl)sulfanyl]acetat (IUPAC) | |||||||||||||||
| Summenformel | C28H45NO5S | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code |
J01XX12 | |||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Wirkmechanismus |
Elongationsphase-Hemmung | |||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 507,73 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Eigenschaften
Lefamulin ist eine halbsynthetisch hergestellte Substanz, die arzneilich als Lefamulinacetat[3] eingesetzt wird und sowohl oral als auch intravenös gegeben werden kann.
Lefamulin ist Herstellerangaben zufolge das erste systemisch wirksame Antibiotikum für die Humanmedizin aus der Gruppe der Pleuromutiline.[4] Diese aus Pilzen (Clitopilus passeckerianus, „Katzenohrräsling“) stammende Gruppe von Naturstoffen wurde bereits in den 1950er Jahren entdeckt. Von der Leitsubstanz Pleuromutilin leiten sich außer Lefamulin auch das früher bei Hautinfektionen topisch eingesetzte Retapamulin sowie die in der Tiermedizin verwendeten Wirkstoffe Tiamulin and Valnemulin ab.
Die Wirkung beruht auf einer Hemmung der bakteriellen Proteinsynthese, indem Lefamulin in der 50S-Untereinheit der Ribosomen an das in der Domäne V der 23S rRNA gelegene Peptidyltransferase-Zentrum bindet.[5] Der Mechanismus unterscheidet sich von anderen Antibiotika, die ihren Angriffspunkt an bakteriellen Ribosomen haben. Es wird erwartet, dass Lefamulin daher auch bei bereits erfolgter Resistenzbildung wirksam sei.[6]
Wirkspektrum
Das Wirkspektrum umfasst neben der Aktivität gegen grampositive Keime (Streptococcus pneumoniae, Staphylococcus aureus) auch gramnegative Bakterien wie Haemophilus influenzae, Legionella pneumophila, Mycoplasma pneumoniae und Chlamydophila pneumoniae.[4][5] Nicht wirksam ist Lefamulin gegen Enterobakterien und Pseudomonas aeruginosa.[5]
Klinische Angaben
Die Zulassung gründet sich auf die Ergebnisse der beiden Phase-III-Studien LEAP1[7] und LEAP2[8] mit insgesamt 1289 Patienten mit einer ambulant erworbenen Pneumonie. Lefamulin wurde mit dem Antibiotikum Moxifloxacin in Kombination mit oder ohne Linezolid verglichen. In LEAP1 wurden die Wirkstoffe intravenös und in LEAP2 oral verabreicht. In beiden Studien erzielte Lefamulin eine ähnlich gute klinische Erfolgsrate wie die Vergleichstherapie.
Zu den häufigsten Nebenwirkungen gehörten Durchfall, Übelkeit, Reaktionen an der Injektionsstelle, erhöhte Leberenzymwerte und Erbrechen. Lefamulin kann zu einer Verlängerung des QT-Intervalls führen, was das Risiko für lebensgefährliche Herzrhythmusstörungen erhöht. In Tierexperimenten wurde zudem eine Fruchtschädigung beobachtet.[9][6][10]
Handelsnamen
Nabriva Therapeutics: Xenleta (EU, USA)
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Xenleta. European Medicines Agency, 6. August 2020, abgerufen am 22. April 2021 (englisch).
- Externe Identifikatoren von bzw. Datenbank-Links zu Lefamulinacetat: CAS-Nummer: 1350636-82-6, EG-Nummer: 695-920-8, ECHA-InfoCard: 100.224.747, PubChem: 86346053, ChemSpider: 34980596, Wikidata: Q27279882.
- M.P. Veve, J.L. Wagner: Lefamulin: Review of a Promising Novel Pleuromutilin Antibiotic. Pharmacotherapy. 38 (2018), Bd. 9, S. 935–946. doi:10.1002/phar.2166.
- Prescribing Information Xenleta, August 2019. (PDF; 612 kB) Nabriva Therapeutics US, Inc. (englisch).
- K. Gräfe: US-Zulassung für neues Antibiotikum, Pharmazeutische Zeitung, 22. August 2019.
- T. M. File et al.: Efficacy and Safety of Intravenous-to-oral Lefamulin, a Pleuromutilin Antibiotic, for the Treatment of Community-acquired Bacterial Pneumonia: The Phase III Lefamulin Evaluation Against Pneumonia (LEAP 1) Trial. Clinical Infectious Diseases, Februar 2019. doi:10.1093/cid/ciz090.
- E. Alexander et al.: Oral Lefamulin vs Moxifloxacin for Early Clinical Response Among Adults With Community-Acquired Bacterial Pneumonia: The LEAP 2 Randomized Clinical Trial. JAMA, September 2019. doi:10.1001/jama.2019.15468.
- C. Möthrath: FDA erteilt Zulassung für Xenleta, apotheke adhoc, 22. August 2019.
- Lefamulin: Neuartiges Antibiotikum in den USA zugelassen, aerzteblatt.de, 20. August 2019.