Humanes Herpesvirus 8
Das Humane Herpesvirus 8 (wissenschaftlich Human gammaherpesvirus 8, HHV-8; gelegentlich auch Kaposi-Sarkom-Herpesvirus, KSHV genannt) ist eine Spezies (Art) humanpathogener Herpesviren aus der Unterfamilie der Gammaherpesviren. Es verursacht das Kaposi-Sarkom und bestimmte seltene maligne Lymphome.
| Humanes Herpesvirus 8 | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Systematik | ||||||||||||||||||||
| ||||||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||||||
| ||||||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||||||
| Human gammaherpesvirus 8 | ||||||||||||||||||||
| Kurzbezeichnung | ||||||||||||||||||||
| HHV-8 | ||||||||||||||||||||
| Links | ||||||||||||||||||||
|
Historisches
HHV-8 wurde im Jahr 1994 durch die Arbeitsgruppe um den US-amerikanischen Virologen Patrick S. Moore und seine Ehefrau Yuan Chang an der Columbia University entdeckt.[2] Sie benutzten dabei eine spezielle PCR-Methode, die representational difference analysis. Dadurch gelang der Nachweis von Herpesvirus-ähnlichen DNA-Sequenzen im Gewebe von Kaposi-Sarkomen, die von HIV-infizierten Patienten stammten. Rasch wurde klar, dass es sich um ein neues, bisher unbekanntes Herpesvirus handelte.
Seit der Entdeckung von HIV Anfang der 1980er-Jahre war aufgefallen, dass AIDS-Patienten häufiger bestimmte bösartige Erkrankungen entwickelten. Besonders auffällig war dies beim Kaposi-Sarkom, das vor der HIV-Pandemie ein nur selten zu sehender Haut-Tumor gewesen war. Bei AIDS-Patienten war das Kaposi-Sarkom jedoch ca. 1000 mal häufiger anzutreffen als bei der übrigen Bevölkerung. Bemerkenswert war auch, dass männliche AIDS-Patienten deutlich häufiger am Kaposi-Sarkom erkrankten als weibliche AIDS-Patienten.
Dies führte zu der Hypothese, dass das Kaposi-Sarkom durch ein infektiöses Agens verursacht sein könnte, das bei der durch HIV verursachten Immunschwäche auflebte und zur Tumorbildung führte. Das gehäufte Auftreten bei männlichen Homosexuellen wurde durch Infektion bei den dort geübten Sexualpraktiken (Anal- und Oralverkehr) erklärt.
Moore und Chang gingen dieser Hypothese nach und entdeckten schließlich das Virus.
Epidemiologie
Der Nachweis einer Infektion wird in der Regel serologisch, das heißt durch den Nachweis von Antikörpern gegen HHV-8 geführt. Die Seroprävalenz (Häufigkeit von Antikörpern) ist je nach Weltregion sehr unterschiedlich. In Nordamerika und Europa liegt sie bei etwa 1 bis 3 %, in Äquatorialafrika liegt sie in einigen Gebieten bei bis zu 50 %. Damit ist das HHV-8 im Vergleich zu anderen menschlichen Herpesviren (Epstein-Barr-Virus, Varizella-Zoster-Virus, Herpes-simplex-Virus I und II), die eine Seroprävalenz von weit über 50 % in der Erwachsenen-Bevölkerung in Europa aufweisen, relativ selten. Bei einer Untersuchung von Brustkrebsbiopsaten in Taiwan waren 42 % der Proben von HHV-8 infiziert.[3]
Übertragung
Die Übertragung von HHV-8 erfolgt wahrscheinlich – wie bei anderen Herpesviren auch – über den Speichel und andere Körpersekrete:[4]
- sexuelle Übertragung: oro-genital, oro-anal und oro-oral (Küssen)
- asexuelle Übertragung: Speichelkontakt durch Küssen von Mutter zu Kind, vorgekaute Nahrung
Durch HHV-8 verursachte Erkrankungen
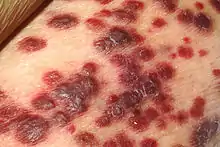
Die Beteiligung von HHV-8 gilt als gesichert bei der Entstehung dreier Krankheiten:
- dem Kaposi-Sarkom
- den sogenannten Lymphomen in serösen Körperhöhlen (Pleurahöhle, Perikardhöhle, Peritonealhöhle; body cavity-based lymphoma, oder primary effusion lymphoma (PEL))
- bestimmten Formen der multizentrischen Castleman-Erkrankung
Alle genannten Erkrankungen sind selten, treten aber gehäuft bei Immunschwäche auf. Nur ein geringer Prozentsatz der mit HHV-8 Infizierten erkrankt an einer dieser Krankheiten. Eine wirksame Impfung gegen das Virus existiert bisher nicht.
HHV-8 gehört zusammen mit dem Hepatitis-B-Virus (HBV), dem Hepatitis-C-Virus (HCV), dem Epstein-Barr-Virus (EBV), den Humanen Papillomaviren (HPV) und dem Humanen T-lymphotropen Virus 1 zu einer Gruppe von humanen cancerogenen Viren, die weltweit für 10 bis 15 Prozent aller Krebserkrankungen verantwortlich sind.[5]
Genetik und biologische Besonderheiten des Virus
HHV-8 wird zum Genus Rhadinovirus der Gammaherpesviren gezählt. Das ca. 165.000 Basenpaare umfassende Doppelstrang-DNA-Virusgenom ist wie bei allen Herpesviren vergleichsweise komplex aufgebaut und codiert für viele Gene. Interessant ist, dass das HHV-8-Genom viele Gene beinhaltet, die hohe Homologie zu zellulären menschlichen Genen haben (z. B. Interleukin-6, Cyclin D1, BCL-2 etc.). Dadurch ist das Virus in der Lage, das Zellverhalten in komplexer Weise zu beeinflussen. Die Tumor-auslösende Wirkung wird auch auf diese Virusgene zurückgeführt. Wie alle Herpesviren verfügt HHV-8 über die Fähigkeit zur Viruslatenz, d. h. das Virus kann lange Zeit im Organismus scheinbar inaktiv überdauern und so dem Immunsystem entkommen. Das HHV-8 bindet an Integrin β-3.
Bei einer Infektion bildet das Protein ORF20 des Herpesvirus mit einem Wirtsprotein der angeborenen Immunabwehr einen Komplex. An sich dient das Wirtsprotein OASL der Wirtsabwehr, es wirkt antiviral. Bei der Infektion kehrt sich dies um, so dass OASL die Infektion erleichtert, da das Virusprotein ORF20 vorliegt. Das Virus schlägt seinen Wirt mit den eigenen Waffen.[6]
Weblinks
- Patrick S. Moores Labor
- Human Herpesvirus-8: Related Resources HIV InSite (englisch)
Einzelnachweise
- ICTV:ICTV Taxonomy history: Human alphaherpesvirus 1, EC 51, Berlin, Germany, July 2019; Email ratification March 2020 (MSL #35)
- Y. Chang, E. Cesarman, M. S. Pessin, F. Lee, J. Culpepper, D. M. Knowles, P. S. Moore: Identification of herpesvirus-like DNA sequences in AIDS-associated Kaposi’s sarcoma. In: Science. 266, 1994, S. 1865–1869. PMID 95090463
- J. H. Tsai, C. H. Tsai, M. H. Cheng, S. J. Lin, F. L. Xu, C. C. Yang: Association of viral factors with non-familial breast cancer in Taiwan by comparison with non-cancerous, fibroadenoma, and thyroid tumor tissues. In: J med Virol., 75, 2005, S. 276–281.
- Ulrike Wieland: Beta und Gamma Herpesviren. Scriptum Uni Köln, 2005, medizin.uni-koeln.de (PDF)
- D. Martin, J. S. Gutkind: Human tumor-associated viruses and new insights into the molecular mechanisms of cancer. In: Oncogene. Band 27, Nr. 2, 2008, S. 31–42, PMID 19956178.
- Kendra A. Bussey, Ulrike Lau, Sophie Schumann, Melanie Brinkmann et al.: The interferon-stimulated gene product oligoadenylate synthetase-like protein enhances replication of Kaposi’s sarcoma-associated herpesvirus (KSHV) and interacts with the KSHV ORF20 protein. In: PLOS Pathogens, 2018, doi:10.1371/journal.ppat.1006937