Hopfenbitterstoffe
Hopfenbitterstoffe bestimmen die charakteristische Bitterkeit von Bier. Die gesamte Gruppe der Hopfenbitterstoffe besitzt sedierende, antibiotische und estrogene Eigenschaften. Sie wird unterteilt in die sich vom Humulon ableitenden „Humulone“ und in die „Lupulone“, die Abkömmlinge des Lupulons (β-Lupulinsäure) darstellen.[1] Hopfenbitterstoffe sind sehr instabil; durch oxidativen Abbau entstehen verschiedene Verbindungen, darunter das 2-Methylbut-3-en-2-ol, für das im Tierexperiment sedierende Wirkungen festgestellt wurden. Hopfenzapfen (Hopfenblüten) und Hopfendrüsen (Lupulin) sind als milde Beruhigungsmittel verwendete pharmazeutische Drogen.
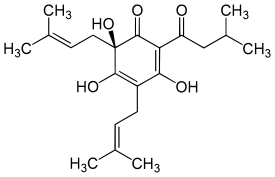
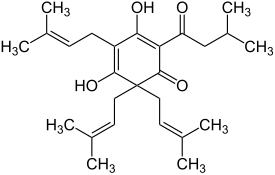
Allgemein
Die Bitterstoffe stammen aus den Drüsenhaaren (Becherdrüsen, Lupulindrüsen am unteren Ende der Vorblätter) der weiblichen Blüten (Hopfenzapfen) des Hopfens (Humulus lupulus), die unter anderem ein harzartiges Exkret enthalten.[2][3] Unterschieden wird dabei zwischen Hartharz und Weichharz, wobei Weichharz gut in Hexan löslich ist, Hartharz dagegen nicht.[4] Das Weichharz lässt sich weiterhin in α- und β-Weichharz unterteilen.[2] Das α-Weichharz besteht vorrangig aus den Humulonen (α-Säuren).[5][6] Die Menge der α-Säuren ist abhängig von Sorte, Provenienz, Jahrgang, dem Zeitpunkt der Ernte, der Behandlungsweise und dem Alter des Hopfens.[5] Das β-Weichharz enthält die Lupulone (β-Säuren).[2]
Das Harz in den luftgetrockneten Hopfenzapfen setzt sich wie folgt zusammen:[7]

Humulone
Die Humulone des α-Weichharzes bestehen hauptsächlich aus Humulon (α-Lupulinsäure) und daneben aus dessen Derivaten, den sog. Co-, Prae-, Ad-, Adpre- und Posthumulonen.[2]
Chemische Eigenschaften
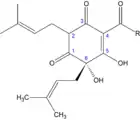
Humulone sind strukturell betrachtet Derivate des Phloroglucins (1,3,5-Trihydroxybenzol), wobei an C2 und C6 generell zwei isoprenoide Seitenketten auftreten, an C6 eine zusätzliche OH-Gruppe und an C4 ein Acylrest vorliegt.[2] Durch die beiden Reste an C6 wird die aromatische Grundstruktur des Phloroglucins aufgehoben und zwei der ursprünglich drei OH-Gruppen des Grundkörpers liegen als Ketofunktionen vor. Zusätzlich entsteht an C6 ein stereogenes Zentrum. Die Humulone unterscheiden sich durch ihre unterschiedlichen Reste an der Seitenkette an C4.
| α-Säuren | Rest R | [%] |
|---|---|---|
| Humulon | CH2CH(CH3)2 | 35–70 |
| Cohumulon | CH(CH3)2 | 20–65 |
| Adhumulon | CH(CH3)CH2CH3 | 10–15 |
| Prähumulon | CH2CH2CH(CH3)2 | 1–10 |
| Posthumulon | CH2CH3 | 1–3 |
Das Humulon und dessen Derivate haben einen pKs-Wert von 4,7 bis 5,7 und liegen daher in Wasser schwach dissoziiert vor.[5][8][9] Es handelt sich demzufolge um schwache Säuren, die eine geringe Wasserlöslichkeit besitzen.[5][8][9] Bei einem pH-Wert von 5,9 lösen sich 480 mg/L der Humulone, bei pH 5,0 nur 40 mg/L bei 25 °C und 60 mg/L bei 100 °C.[10] Da während des Brauprozesses, z. B. bei der Gärung, ein pH-Sturz hervorgerufen wird, würden die Humulone nicht, bzw. nur in sehr geringen Mengen in das Getränk übergehen.[10] Um die Löslichkeit der Humulone zu erhöhen, werden diese daher beim Würzekochen in ihre Isomere, die Isohumulone, umgewandelt.[10]
Bei den Humulonen handelt es sich nämlich um sehr labile Substanzen, die durch Wärme, Luftsauerstoff oder Lagerung leicht in eine Vielzahl von Folgeprodukten überführt werden können.[2] Beispielsweise entstehen dabei durch Ringverengung aus dem Sechsring der Humulone die Isohumulone, die aus einem Fünfring aufgebaut sind.[2] Isohumulone besitzen zudem einen höheren Bitterwert.[2] Diese Veränderungen geschehen leicht, da es sich um unbeständige, empfindliche Körper aufgrund ihrer Konstitution handelt.[11] Das Vorliegen des β-Tetracarbonyl-Systems und deren Tautomere (im Fall der Humulone durch Enolisierung an C5) bewirkt die Empfindlichkeit sowohl in alkalischer als auch in saurer Lösung.[11]
Bakteriostatische Wirkung
Die Humulone besitzen eine bakteriostatische Aktivität gegen grampositive Bakterien, wobei diese auf Wechselwirkungen zwischen den Isoprenylgruppen der Bitterstoffe und der Zellplasmamembran der Bakterien beruht.[8] Je mehr Isoprenylgruppen ein Bitterstoffmolekül besitzt, desto bakteriostatischer ist demnach die Wirkung.[8] Sie wirken z. B. gegen die Erreger der Tuberkulose.[5]
Entzündungshemmende Wirkung
Nachgewiesen wurde eine entzündungshemmende Wirkung des Humulons, bei der es zu einer Unterdrückung der Transkription des der Cyclooxygenase-2 (COX-2) zugehörigen Gens kommt, wodurch die Bildung von Prostaglandinen inhibiert wird.[12]
Analytik
Die zuverlässige Bestimmung der einzelnen Wirkstoffe gelingt durch spektroskopische Methoden sowie durch die Kopplung der HPLC mit der Massenspektrometrie. Ergänzt werden diese Methoden durch sensorische Verfahren.[13][14]
Reaktionen
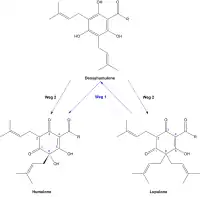
Biochemische Reaktionen
Der Biosyntheseweg der Humulone und Lupulone ist noch nicht vollständig geklärt.[5] Eine mögliche Theorie besteht darin, dass bei der Biogenese zunächst die Lupulone gebildet werden und aus diesen über das Desoxyhumulon die Humulone entstehen (Weg 1).[5] Einer anderen Theorie zufolge soll der Biosyntheseweg über das Desoxyhumulon als gemeinsame Vorstufe der Humulone und Lupulone verlaufen (Weg 2).[5] Da der Quotient Lupulone zu Humulone während der Reifungsphase abnimmt, ist zu vermuten, dass zuerst die Lupulone und dann erst die Humulone gebildet werden und somit Weg 1 der bedeutendere ist.[5]
Folgeprodukte
Durch Trocknung, Lagerung, Verarbeitung und Würzekochung beim Brauprozess entsteht aus den Humulonen und Lupulonen eine Vielzahl von Folgeprodukten.[5][6] Diese unterscheiden sich stark in der Intensität des Bittergeschmacks.[5][6]
Durch Ringverengung des Sechsrings der Humulone bildet sich das Fünfringsystem der Isohumulone.[15]
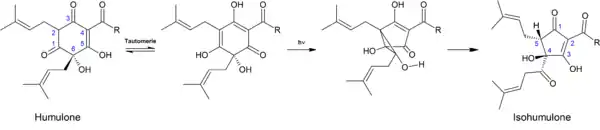
Der Mechanismus besteht aus einer Oxa-Di-π-Methan-Umlagerung gefolgt von einer Öffnung des dabei entstandenen Cyclopropanol-Rings.[15]
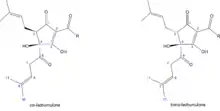
Dabei können aus den jeweiligen Humulonen die entsprechenden cis- und trans-Isohumulone entstehen. Bei den cis-Isohumulonen weisen die OH-Gruppe am C4 und der Isoprenylrest am C5 auf die gleiche Molekülseite. Bei den trans-Isohumulonen stehen diese in entgegengesetzter Richtung.
Auffällige Unterschiede existieren zwischen den Stereoisomeren. Die cis-Isohumulone (Halbwertszeit > 5 Jahre) weisen dabei eine deutlich höhere Stabilität auf als die entsprechenden trans-Isomere (Halbwertszeit ca. 1 Jahr) auf. In welchem Verhältnis die cis-/trans-Isomere gebildet werden, hängt von den Reaktionsbedingungen ab. Im Würzemedium werden normalerweise jedoch doppelt so viele cis- wie trans-Isohumulone gebildet.[8]
Isohumulone sind deutlich bitterer und leichter löslich als ihre Ausgangsstoffe.[5] Während des Brauprozesses ist es daher erwünscht, die Humulone in ihre Isomere zu überführen.[6] Der Geschmacksschwellenwert der Isohumulone beträgt ungefähr 6 mg/L.[6] Sie bilden den quantitativ bedeutendsten Teil im Hinblick auf den Bittergeschmack von Bieren.[8] Biere enthalten oft zwischen 15 mg/L (Amerikanische Lager Biere) und 100 mg/L (Englische Ales) dieser Verbindungen.[8] Der Gehalt in Weizenbieren liegen oft auch unter 10 mg/L.
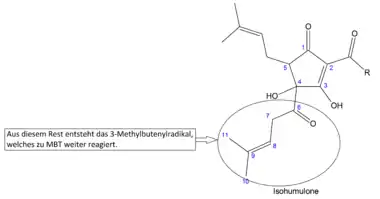
Bier ist im Handel meist nur in gefärbten Flaschen erhältlich, um den Lichtgeschmack durch die Zersetzung der Hopfenbitterstoffe in 3-Methyl-2-buten-1-thiol zu vermeiden, die auf einer photolytischen Reaktion basiert, wobei Riboflavin als Katalysator dient. Braune Flaschen haben dabei eine messbar bessere Filterwirkung als grüne oder auch weiße.[9][15]
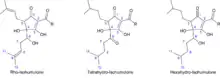
Aus Isohumulon kann durch eine α-Spaltung an der (R-CO-)Bindung – Norrish-Typ-I-Reaktion – das 3-Methylbutenylradikal abgespalten werden. Dieses setzt aus natürlich vorkommenden Schwefelverbindungen (Proteine) im Bier Thiole wie das 3-Methyl-2-buten-1-thiol (MBT) frei, die dem Bier einen unangenehmen Geschmack und animalischen[8] Geruch verleihen (lightstruck/skunky flavor).[9][15] Die Freisetzung des unerwünschten MBT kann verhindert werden, indem die Isohumulone in ihre reduzierten Formen überführt werden.[16] Dabei wird die Carbonylgruppe am C6 bzw. die C=C-Doppelbindung am C8 der Isohexenylseitenkette reduziert, wodurch vermutlich die Bildung des 3-Methylbutenylradikals verhindert wird.[9][15] Die reduzierten Isohumulone sind stabiler und zeichnen sich durch eine z. T. größere Bittere und verbesserte Schaumstabilität aus (siehe Tabelle 1).[16] Sie können auch erst später dem Brauvorgang zugegeben werden und gelten laut einer Studie als nicht gesundheitsschädlich.[17]
| Relative Bittere | Fähigkeit zur Schaumstabilisierung | |
|---|---|---|
| Isohumulone | 1,0 | xx |
| Dihydro-Isohumulone (Rho-) | 0,6–0,7 | xx |
| Tetrahydro-Isohumulone | 1,5–1,9 | xxx |
| Hexahydro-Isohumulone | 1,0–1,2 | xxxx |
Anwendung in der Industrie
Beim traditionellen Brauverfahren werden getrocknete Hopfenzapfen zur Würze hinzugefügt und für mindestens eine Stunde in der Würzepfanne gekocht. Dabei werden die Humulone extrahiert und in ihre Isomere umgewandelt, die Isohumulone. Die Ausbeute der Hopfenbitterstoffe beim traditionellen Brauverfahren ist jedoch schlecht, und typischerweise gehen nur etwa 30 % der im Hopfen vorhandenen Humulone als Isohumulone in das Bier über. Heutzutage werden meist Hopfenpellets statt getrockneten Hopfenzapfen verwendet. Diese bestehen aus gemahlenem Hopfen, der in Pellets gepresst und unter Inertgasatmosphäre verpackt wird. Die Hopfenpellets besitzen den Vorteil einer besseren Lagerfähigkeit, geringere Oxidationsreaktionen und ein kleineres Volumen. Die Effizienz, durch die Bier mit Hopfen gebittert werden kann, kann durch eine gesonderte Extraktion der Humulone aus dem Hopfen mit überkritischem Kohlenstoffdioxid oder Ethanol gesteigert werden. Deshalb findet man auf vielen Bierflaschen neben Hopfen auch Hopfenextrakt auf der Zutatenliste.[9]
Verfahrenstechnische Anwendung in der Industrie
Heutzutage wird der Hopfen zuerst mit überkritischem CO2 extrahiert. Der Extrakt enthält Humulone, Lupulone, Hopfenöle und einige Fette und Wachse geringer Molekülmasse. Die im Extrakt enthaltenen Humulone können durch Einsatz von Hitze, Alkali und Magnesiumionen, welche die Isomerisierungsreaktionen beschleunigen,[9] in wässriger Suspension in Isohumulone umgewandelt werden. Durch fraktionierte Fällungsschritte, unter Verwendung von Mineralsäuren, werden die Isohumulone vom Reaktionsgemisch abgetrennt und gereinigt.[9] Unter Verwendung derartig zubereiteter Isohumulone kann die Ausbeute der ursprünglichen Humulone auf bis zu 80 % verbessert werden.[9] In den meisten Fällen wird auch eine wesentliche Verringerung der Kosten zum Bittern von Bier festgestellt.[9] Dieses Verfahren entspricht jedoch nicht dem Deutschen Reinheitsgebot.
Lupulone
| β-Säuren | Rest R | [%] |
|---|---|---|
| Lupulon | CH2CH(CH3)2 | 35–55 |
| Colupulon | CH(CH3)2 | 20–55 |
| Adlupulon | CH(CH3)CH2CH3 | 10–15 |
| Prälupulon | CH2CH2CH(CH3)2 | 1–3 |
| Postlupulon | CH2CH3 | ? |
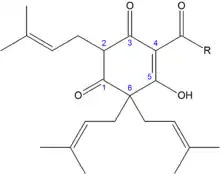
Das β-Weichharz enthält als Hauptbestandteil das Lupulon (β-Lupulinsäure) und als Nebenbestandteile dessen Derivate, den Co-, Prae-, Ad- und Postlupulonen.[2] Auch die Lupulone sind strukturell betrachtet Derivate des Phloroglucins mit drei isoprenoiden Seitenketten, die eine Acylgruppe tragen.[2]
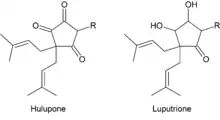
Sie unterscheiden sich von den Humulonen dadurch, dass die Hydroxygruppe am stereogenen Zentrum C6 des Humulons durch eine zusätzliche Isopreneinheit ersetzt ist.[10] Daher sind die Lupulone unpolarer als die Humulone und besitzen eine noch geringere Wasserlöslichkeit.[10] Bei einem pH-Wert zwischen pH 5–6 lösen sich bei 25 °C nur 1,5 mg/L und bei 100 °C 9 mg/L der Lupulone.[10] Die Lupulone werden analog zu den Humulonen in bitter schmeckende Verbindungen umgewandelt.[2] Einige Folgeprodukte der Lupulone, die Hulupone bzw. die Luputrione haben einen besonders angenehmen milden Bittergeschmack.[6][18] Sie sind aber deutlich weniger bitter und wesentlich schlechter löslich, so dass der Bittergeschmack des Bieres vorwiegend von der Humulonfraktion geprägt wird.[6] Viele andere Oxidationsprodukte der Lupulone besitzen stattdessen jedoch einen unangenehmen Geschmack, sodass zum Bierbrauen des Öfteren lupulonarme Hopfensorten benutzt werden.[8] Dementsprechend unbedeutender sind sie für die Bierindustrie.[8]
Einzelnachweise
- R. Hegnauer: Chemotaxonomie der Pflanzen. Band 3: Dicotyledoneae: Acanthaceae - Cyrillaceae. Birkhäuser, 2014, ISBN 978-3-7643-0166-8, S. 353.
- Max Wichtl: Hopfen (Humulus Lupulus): Ein nach wie vor wichtiger Bestandteil pflanzlicher Sedativa. In: Schweiz. Zschr. GanzheitsMedizin. 17, 2005, S. 95–99. Verlag für GanzheitsMedizin, Basel. www.ganzheits-medizin.ch.
- Johann Maier: Zur Kenntnis der Hopfenbitterstoffe 4-Desoxy-humulon und α+β-Weichharz. Dissertation, TH München. Freising-Weihenstephan 1962, S. 6 ff.
- Jana Nagel: EST-Analyse von Humulus lupulus L.-Trichomen – Identifizierung einer O-Methyltransferase, welche die Biosynthese von Xanthohumol katalysiert. Dissertation. Halle (Saale) 2009, S. 6.
- Ludwig Narziß, Werner Back: Die Bierbrauerei. Band 2: Die Technologie der Würzebereitung. 8., überarb. und erw. Auflage. Wiley-VCH, Weinheim 2009, ISBN 978-3-527-32533-7, S. 63 ff.
- H. D. Belitz, W. Grosch, P. Schieberle: Lehrbuch der Lebensmittelchemie. 6., vollständig überarbeitete Auflage. Springer-Verlag, Berlin/ Heidelberg 2008, ISBN 978-3-540-73201-3, S. 923 ff.
- Johannes Beier: Über die Biosynthese der Hopfenbitterstoffe. Dissertation. TU München, 1973, S. 3 f.
- Denis de Keukeleire: Fundamentals Of Beer And Hop Chemistry. In: Química Nova. Vol. 23, No. 1, São Paulo Jan./Feb. 2000.
- Patent DE69934830T2: Verfahren zur Hydrierung von Hopfenharzsäuren. Angemeldet am 18. November 1999, veröffentlicht am 12. Juli 2007, Anmelder: S. S. Steiner Inc, Erfinder: Robert J. Smith, Richard J. H. Wilson.
- Ludwig Narziß, Werner Back: Die Bierbrauerei. Band 2: Die Technologie der Würzebereitung. 8., überarb. und erw. Auflage. Wiley-VCH, Weinheim 2009, ISBN 978-3-527-32533-7, S. 269.
- Johann Maier: Zur Kenntnis der Hopfenbitterstoffe 4-Desoxy-humulon und α+β-Weichharz. Dissertation, TH München. Freising-Weihenstephan 1962, S. 2.
- K. Yamamoto, J. Wang, S. Yamamoto, H. Tobe: Suppression of Cyclooxygenase-2 Gene Transcription by Humulone. In: Kenneth V. Honn, Lawrence J. Marnett, Santosh Nigam, Edward Dennis, Charles Serhan (Hrsg.): Eicosanoids and other bioactive lipids in cancer, inflammation, and radiation injury. Band 5, Springer, 2002, ISBN 0-306-47283-X, S. 73–76.
- M. Dresel, A. Dunkel, T. Hofmann: Sensomics analysis of key bitter compounds in the hard resin of hops (Humulus lupulus L.) and their contribution to the bitter profile of Pilsner-type beer. In: J Agric Food Chem. 63(13), 8. Apr 2015, S. 3402–3418. PMID 25793563
- M. Dušek, J. Olšovská, K. Krofta, M. Jurková, A. Mikyška: Qualitative determination of β-acids and their transformation products in beer and hop using HR/AM-LC-MS/MS. In: J Agric Food Chem. 62(31), 6. Aug 2014, S. 7690–7697. PMID 25099125
- Birgit Witte: Photochemische und thermische Anellierungsreaktionen von konjugierten Alenylcyclohex-2-enonen. Dissertation. Hamburg 1999, S. 5 f.
- Stefan Hanke: Untersuchungen zum Einfluss der Hopfungstechnologie auf die Geschmacksstabilität und Harmonie untergäriger Biere. Dissertation. Technische Universität München, 2009, S. 42.
- C. I. Chappel, S. Y. Smith, M. Chagnon: Subchronic Toxicity of Tetrahydroisohumulone and Hexyhydroisohumulone in the Beagle Dog. In: Food and Chemical Toxicology. 36, Elsevier 1998, S. 915 ff.
- Gesa Haseleu, Daniel Intelmann, Thomas Hofmann: Structure determination and sensory evaluation of novel bitter compounds formed from β-acids of hop (Humulus lupulus L.) upon wort boiling. In: Food Chemistry. 116, Elsevier 2009, S. 71–81.