Hexafluorethan
Hexafluorethan ist eine chemische Verbindung aus der Gruppe der Fluorkohlenwasserstoffe und ist als aliphatisches gesättigtes Fluorkohlenwasserstoff ein Perfluorcarbon.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
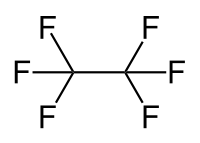 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Hexafluorethan | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C2F6 | |||||||||||||||
| Kurzbeschreibung |
farb- und geruchloses Gas[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 138,01 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte |
6,25 kg·m−3 (unter Normalbedingungen)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
−78,2 °C[1] | |||||||||||||||
| Löslichkeit |
geringfügig löslich in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Treibhauspotential |
12340 (bezogen auf 100 Jahre)[2] | |||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−1344,2 kJ/mol[3] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Darstellung und Gewinnung
Eine Synthesevariante ist die Umsetzung von Trifluoressigsäure mit Xenondifluorid. Hier werden zunächst die instabilen Ester (CF3COO)2Xe und (CF3COO)XeF gebildet, deren Zersetzung bzw. Decarboxylierung zu Trifluormethylradikalen und dann zum Hexafluorethan führt.[4]
Eigenschaften
In Druckgasflaschen liegt Hexafluorethan als verdichtetes Gas vor. Unter 19,7 °C unter Druck ist es ein verflüssigt vorliegendes Gas. Beim Ausströmen der Flüssigkeit oder beim Entweichen großer Gasmengen bilden sich kalte Nebel, die sich am Boden ausbreiten. Oberhalb von 800 °C zersetzt sich die Verbindung, wobei unter Luft Fluorwasserstoff, Kohlenstoffmonoxid und Kohlenstoffdioxid entstehen. Der kritische Punkt liegt bei 19,89 °C, 30,39 bar und 0,601 kg·l−1; der Tripelpunkt bei −100,10 °C und 0,26490 bar.[5]
Hexafluorethan besitzt ein Treibhauspotenzial von 12340 und ein Ozonabbaupotential von 0.[1]
Verwendung
Hexafluorethan wird in der Halbleiter-Industrie als Ätzgas und beim Plasmaätzen, sowie zum Reinigen von CVD-Kammern eingesetzt.[6] Es dient weiterhin als Treibgas, gasförmiger Isolierstoff (in aufgeschäumten Stoffen) und als Kältemittel.[7] Große Mengen Hexafluorethan werden bei der Aluminiumerzeugung freigesetzt. In der Medizin wird es eingesetzt, um bei Glaskörperabhebung und Netzhautablösung den Glaskörper zu ersetzen[8]. Das Gas wird danach von Körper resorbiert und durch Flüssigkeit ersetzt.
Sicherheitshinweise
Hexafluorethan ist schwerer als Luft und in hohen Konzentrationen erstickend.
Einzelnachweise
- Eintrag zu Hexafluorethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Februar 2017. (JavaScript erforderlich)
- G. Myhre, D. Shindell et al.: Climate Change 2013: The Physical Science Basis. Working Group I contribution to the IPCC Fifth Assessment Report. Hrsg.: Intergovernmental Panel on Climate Change. 2013, Chapter 8: Anthropogenic and Natural Radiative Forcing, S. 24–39; Table 8.SM.16 (PDF).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-21.
- e-EROS Encyclopedia of Reagents for Organic Synthesis, 1999–2013, John Wiley and Sons, Inc., Eintrag für Xenon(II)-fluorid, abgerufen am 20. Januar 2018.
- Helmut Schan: Handbuch der reinsten Gase. Springer, 2005, ISBN 978-3-540-23215-5, S. 307.
- Hexafluorethan (airliquide)
- R116 (Linde-Gas)
- Kathrin Kässmann: Die pharmakologische Vitreolyse mittels Ocriplasmin beim vitreomakulären Traktionssyndrom: SD-OCT-morphologische Veränderungen und klinischer Verlauf. (PDF; 1,3MB) Dissertation an der Ludwig-Maximilians-Universität München, 2019.
