Fluorenon
Fluorenon ist ein Derivat des Fluorens (ein polycyclischer aromatischer Kohlenwasserstoff) und gehört zur Gruppe der Aromaten und der Ketone. Unterschied zum Fluoren ist die Ketogruppe am Fünfring (in der 9-Position).
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
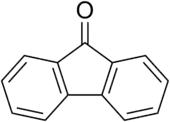 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Fluorenon | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C13H8O | |||||||||||||||
| Kurzbeschreibung |
gelbe Schuppen[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 180,21 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
0,9 g·cm−3 (20 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
342 °C[2] | |||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Brechungsindex |
1,6309 (99 °C)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Geschichte
Derivate des Fluorenons waren die ersten Medikamente weltweit mit einer nachgewiesenen Wirksamkeit gegen Viren in Nagetieren (Tiloron, seit ca. 1970). Die klinische Anwendung wurde jedoch aufgrund fehlender Wirksamkeit im Menschen eingestellt.[5][6][7]
Gewinnung und Darstellung
Fluorenon wird durch Oxidation von Fluoren im basischen Milieu hergestellt:
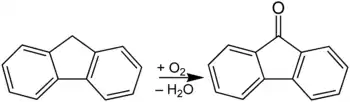
Weiterhin entsteht es (wie das Fluoren) in geringer Konzentration auch bei der Verbrennung von Benzin und Diesel.
Eigenschaften
Der reine Stoff ist eine brennbare, gelbe, kristalline Festsubstanz. Fluorenon besitzt in Lösung eine auffällige, intensive Färbung, welche seine Verwendung in der Chromatographie erklärt. Die im Vergleich zu Fluoren dunklere (gelbe) Farbe resultiert aus der Erweiterung des aromatischen Systems auf das Sauerstoffatom (durch konjugierte Doppelbindungen).
Verwendung
Fluorenon wird als Farbstoff bei der Säulenchromatographie eingesetzt. Einige Derivate wurden schon früher als Anti-Viren-Medikamente (Virostatika) verwendet. Zurzeit laufen Forschungen zur Entwicklung von neuen Chemotherapeutika und Virostatika aus Fluorenon (analog dem Tiloron). Durch passende Substituenten am Molekül soll die Wirksamkeit maximiert und die Nebenwirkungen sollen minimiert werden. Außerdem wird der Wachstumsregulator Chlorflurenol aus Fluorenon synthetisiert.
Sicherheitshinweise
Im Gegensatz zu Fluoren wirkt Fluorenon nicht akut toxisch. Es ist ein starkes Mitogen. Deswegen vermutete karzinogene Eigenschaften lassen sich nicht belegen. Das Fluorenderivat 4-Acetylaminofluoren (AAF) hingegen wirkt auf Tier und Mensch krebserzeugend.[8][9]
Weblinks
- Oxidation von Fluoren (PDF-Datei; 15 kB, niederländisch)
- 9-Fluorenon-Carboxamide (PDF-Datei; 296 kB)
- Stavros Kromidas: Zwei Tests zur Charakterisierung von RP-Phasen. In: Laborpraxis Online. 3. Mai 2006, abgerufen am 15. Juli 2017.
Einzelnachweise
- Eintrag zu FLUORENONE in der CosIng-Datenbank der EU-Kommission, abgerufen am 30. Dezember 2021.
- Eintrag zu Fluoren-9-on in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- Eintrag zu Fluoren-9-on. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. November 2014.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-258.
- H. E. Kaufman, Y. M. Centifanto, E. D. Ellison, D. C. Brown: Tilorone hydrochloride: human toxicity and interferon stimulation. In: Proceedings of the Society for Experimental Biology and Medicine. Society for Experimental Biology and Medicine. Band 137, Nummer 1, Mai 1971, S. 357–360, doi:10.3181/00379727-137-35576, PMID 5581674.
- S. Ekins, M. A. Lingerfelt, J. E. Comer, A. N. Freiberg, J. C. Mirsalis, K. O'Loughlin, A. Harutyunyan, C. McFarlane, C. E. Green, P. B. Madrid: Efficacy of Tilorone Dihydrochloride against Ebola Virus Infection. In: Antimicrobial agents and chemotherapy. Band 62, Nummer 2, 02 2018, S. , doi:10.1128/AAC.01711-17, PMID 29133569, PMC 5786809 (freier Volltext).
- T. Cavlar, T. Deimling, A. Ablasser, K. P. Hopfner, V. Hornung: Species-specific detection of the antiviral small-molecule compound CMA by STING. In: The EMBO Journal. Band 32, Nummer 10, Mai 2013, S. 1440–1450, doi:10.1038/emboj.2013.86, PMID 23604073, PMC 3655471 (freier Volltext).
- Sascha Nikolov: Frühwirkungen genotoxischer und nichtgenotoxischer Kanzerogene (Fluorene) auf die Zellteilung verschiedener Nicht-Targetgewebe bei jungen männlichen Ratten. Jena 2002, DNB 966335503, urn:nbn:de:gbv:27-dbt-000806-2 (Dissertation, Universität Jena).
- Udo Fuchs: Einfluss verschiedener Zellgifte, Mitogene und Schwermetalle auf die Cytochrom P450-abhängige Monooxygenasefunktion in Leberzell-Transplantat-enthaltenden Milzen im Vergleich zur Leber bei der Ratte. Jena 2005, DNB 975818406, urn:nbn:de:gbv:27-dbt-004156-2 (Dissertation, Universität Jena).
