Dichloracetylchlorid
Dichloracetylchlorid ist eine chemische Verbindung aus der Gruppe der Carbonsäurehalogenide. Es ist eine farblose bis gelbliche, an Luft rauchende Flüssigkeit mit stechendem Geruch.[1]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
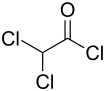 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Dichloracetylchlorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2HCl3O | ||||||||||||||||||
| Kurzbeschreibung |
gelbliche, an der Luft rauchende Flüssigkeit mit stechendem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 147,39 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,53 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
107 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Brechungsindex |
1,46–1,462[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−280,4 kJ/mol[6] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen
Dichloracetylchlorid kann beim Lichtbogenschweißen entstehen, wenn der Stahl mit Trichlorethylen oder 1,1,1-Trichlorethan gereinigt wurde und sich Reste davon am Material oder in der Luft befinden.[3]
Gewinnung und Darstellung
Dichloracetylchlorid kann durch Oxidation von Trichlorethen, durch Reaktion von Dichloressigsäure und Thionylchlorid oder durch Reaktion von Chloroform und Kohlendioxid in Gegenwart von Aluminiumchlorid hergestellt werden.[3][7]
Eigenschaften
Dichloracetylchlorid reagiert mit Alkalihydroxiden, Alkoholen, Laugen und Wasser.[1] In wässrigem Milieu hydrolysiert es zu Dichloressigsäure und Salzsäure.[3]
Verwendung
Dichloracetylchlorid wird als Zwischenprodukt bei der Herstellung von Arzneistoffen und Pflanzenschutzmitteln sowie für Dichloressigsäure, Dichloressigsäureanhydrid und ihren Estern verwendet.[3]
Sicherheitshinweise
Dichloracetylchlorid-Dämpfe können bei Temperaturen über dem Flammpunkt von 66 °C mit Luft explosive Gemische bilden.[4]
Weblinks
- Eintrag zu Dichloroacetyl chloride in der Spectral Database for Organic Compounds (SDBS) des National Institute of Advanced Industrial Science and Technology (AIST)
Siehe auch
- Chloressigsäurechlorid C2H2Cl2O
- Trichloracetylchlorid C2Cl4O
Einzelnachweise
- Eintrag zu Dichloracetylchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Mark T.D. Cronin: Predicting Chemical Toxicity and Fate. CRC Press, 2004, ISBN 978-0-203-64262-7, S. 399 (eingeschränkte Vorschau in der Google-Buchsuche).
- Toxikologische Bewertung von Dichloressigsäurechlorid (PDF) bei der Berufsgenossenschaft Rohstoffe und chemische Industrie (BG RCI), abgerufen am 22. August 2012.
- Eintrag zu Dichloroacetyl chloride bei ChemBlink, abgerufen am 4. Februar 2018.
- Eintrag zu Dichloroacetyl chloride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-21.
- Google Patents: US3630867A - Process for preparing dichloroacetyl chloride, abgerufen am 4. Januar 2019

