Äquatorial (Chemie)
Der Begriff äquatorial wird in der Chemie benutzt zur Kennzeichnung von Bindungen in Molekülen und zur Richtung des Angriffs eines Elektrophils in einer chemischen Reaktion.
Organische Chemie
Äquatoriale Bindungen
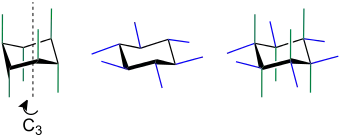
In der Sesselform (Sesselkonformation) des Cyclohexans kommen zwei Arten von C–H-Bindungen vor, die axiale (a) und die äquatoriale (e von englisch equatorial). Die sechs axialen C–H-Bindungen verlaufen parallel zur dreizähligen Achse C3 des Cyclohexanringes. Die sechs äquatorialen C–H-Bindungen liegen im „Äquator“ des Cyclohexans und verlaufen parallel zu den übernächsten C–C-Bindungen.[1] Beim Umklappen wandeln sich die axialen C–H-Bindungen in die äquatorialen C–H-Bindungen und umgekehrt um.[2]
Stellung von Cyclohexansubstituenten
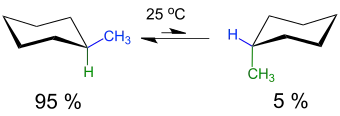
Monosubstituiertes Cyclohexan kann in zwei verschiedenen konformeren Formen vorliegen, wobei ein Substituent R entweder eine äquatoriale oder eine axiale Stellung einnehmen kann. Das Konformere mit der äquatorialen Position des Restes R ist bevorzugt. Die Höhe der Inversionsbarriere (ca. 42 bis 46 kJ·mol−1) ist gering, so dass die Umwandlung der Konformere bei 25 °C mit hoher Geschwindigkeit abläuft (pro Sekunde gibt es etwa 100 000 Übergänge, entsprechend einer Halbwertszeit von 10−6 s) und so die Trennung der Konformere nicht möglich ist. Die Natur des Restes R beeinflusst das Gleichgewicht der Konformere. Beispielsweise liegt im Methylcyclohexan bei 25 °C in etwa 95 % der Moleküle die Methylgruppe in äquatorialer und nur 5 % in axialer Konformation vor.[3]
Äquatorialer elektrophiler Angriff an sechsgliedrigem Ringe mit einem oder mehr sp2-hybridisierten Kohlenstoffatomen
Sechsgliedrige Ringe mit einem sp2-hybridisierten Kohlenstoffatom im Ring werden von einem Elektrophil entweder axial oder äquatorial angegriffen. Enthält der sechsgliedrige Ring zwei oder mehr sp2-hybridisierten Kohlenstoffatome, so erfolgt der Angriff des Elektrophils axial. Das endgültig gebildete Produkt kann den neu eingetretenen Rest in axialer oder äquatorialer Position enthalten, das hat jedoch mit der Dynamik der Addition nichts zu tun.[4]
Anorganische Chemie
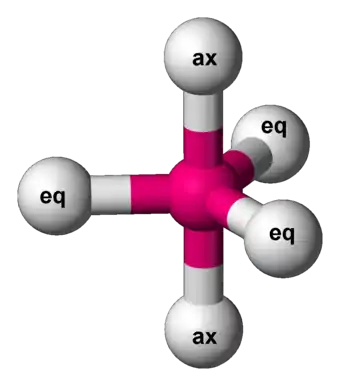
In der anorganischen Chemie wird das Begriffspaar aus äquatorial und axial benutzt, um die Positionsarten von Liganden oder Resten in trigonalen Bipyramiden zu klassifizieren.
Einzelnachweise
- Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 1: A–Cl. 8. neubearbeitete und erweiterte Auflage. Franckh'sche Verlagshandlung, Stuttgart 1979, ISBN 3-440-04511-0, S. 344.
- Joachim Buddrus: Grundlagen der Organischen Chemie, 4. Auflage, de Gruyter Verlag, Berlin, 2011, S. 109, ISBN 978-3-11-024894-4.
- Siegfried Hauptmann: Organische Chemie, 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 112–115, ISBN 3-342-00280-8.
- Jonathan Clayden, Nick Greeves, Stuart Warren, Peter Wothers: Organic Chemistry, Oxford University Press, 2001, S. 858–861, ISBN 978-0-19-850346-0.