Gabriel-Synthese
Die Gabriel-Synthese ist eine Namensreaktion der Organischen Chemie, die nach ihrem Entdecker, dem deutschen Chemiker Siegmund Gabriel (1851–1924), benannt wurde. Sie ist eine chemische Methode zur selektiven Herstellung primärer Amine durch Hydrolyse oder Hydrazinolyse von Phthalimiden. Eine historisch interessante Variante dieser Synthese ist die bereits 1889[1] erfolgte synthetische Darstellung von α-Aminosäuren.
Übersichtsreaktion
Kaliumphthalimid reagiert mit einem Halogenalkan zum entsprechenden N-Alkylphthalimid, das in mehreren Reaktionsschritten durch Hydrolyse oder Hydrazinolyse zu einem primären Amin umgesetzt wird.
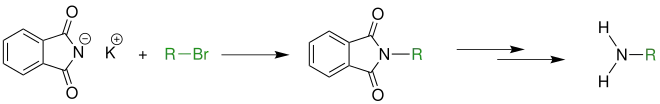
Reaktionsmechanismus
Hydrazinolyse
Im ersten Schritt reagiert Kaliumphthalimid mit einem Halogenalkan (hier ein Alkylbromid) zum entsprechenden N-Alkylphthalimid. Im nächsten Schritt wird im Fall der milder und besser verlaufenden Hydrazinolyse das gebildete N-Alkylphthalimid mit Hydrazin umgesetzt. Die Hydrazinolyse verläuft in einigen Stunden in siedendem Ethanol. Unter diesen milden Bedingungen treten meistens keine Nebenreaktionen auf.[2] Als Produkte entstehen bei dieser sogenannten Ing-Manske-Variante ein cyclisches Phthalhydrazid und das gewünschte primäre Amin. Statt der Hydrazinolyse kann die Aminsynthese auch durch alkalische Hydrolyse erfolgen. Allerdings verläuft die Reaktion nur sehr langsam oder unter drastischen Bedingungen.[3] Die Hydrazinolyse verläuft wegen der benachbarten freien Elektronenpaare im Hydrazin so gut, weil die Nucleophilie des Hydrazins wegen des (α-Effektes) so stark ausgeprägt ist.
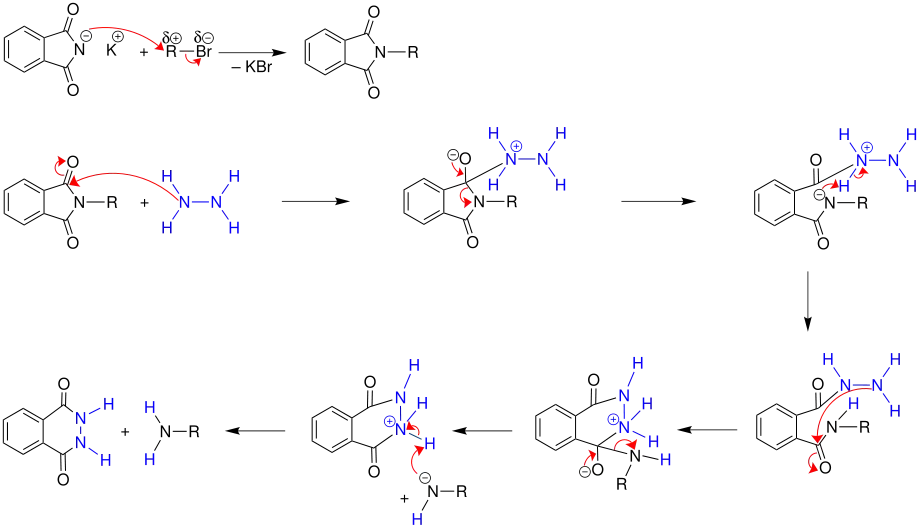
Hydrolyse
Neben der Hydrazinolyse ist die alkalische Hydrolyse der Alkyl-Phthalimide eine alternative Methode zur Herstellung primärer Amine. Das N-Alkylphthalimid wird durch hoch konzentrierte Natronlauge zum Phthalsäureanion und zu einem Alkylamin umgesetzt.

Reaktion mit Brommalonsäureester
Wenn man anstelle von Halogenalkanen Brommalonsäureester als Substrat verwendet, sind α-Aminosäuren zugänglich. Die erste Stufe der Reaktion verläuft wie oben beschrieben, nur dass der Alkylrest R durch den Malonsäureester ersetzt wird. Die folgende Abbildung zeigt den weiteren Reaktionsablauf (Hydrolyse) vom Aminmalonsäureester zur α-Aminosäure Glycin.

Der N-Phthalimidomalonsäureester kann mit einer Vielzahl von Alkylhalogeniden oder α,β-ungesättigten Carbonylverbindungen alkyliert werden, sodass unterschiedliche α-Aminosäuren dargestellt werden können.
Praktische Bedeutung
Die Gabriel-Synthese musste entwickelt werden, weil die Synthese primärer Amine aus Halogenalkanen und Ammoniak nicht möglich ist. Das intermediär entstehende primäre Amin reagiert als besseres Nucleophil viel schneller mit dem Halogenalkan weiter als es aus Ammoniak gebildet wird. Das hat zur Folge, dass am Ende aus dem Reaktionsgemisch nur sehr geringe Mengen an primären Amin isoliert werden können. Hauptprodukte dieser Reaktion wären das tertiäre Amin und das quartäre Ammoniumsalz.
Die Gabriel-Synthese ist ein reines Laborverfahren. Wegen der Bildung stöchiometrischer Mengen mehrerer Abfallstoffe ist die Atomökonomie der Gabriel-Synthese so schlecht, dass niemand eine technische Synthese für primäre Amine basierend auf dieser Reaktion realisiert.
Eine andere Darstellungsmöglichkeit für primäre Amine mit höherer Atomökonomie verläuft über die Umsetzung des Halogenalkans mit Natriumazid zum Alkylazid, aus dem dann reduktiv (etwa mit Lithiumaluminiumhydrid) das primäre Amin gewonnen werden kann. Unter Kettenverlängerung verläuft die Umsetzung des Halogenalkans mit Natriumcyanid mit anschließender Reduktion zum primären Amin.
Einzelnachweise
- L. F. Fieser, M. Fieser, Lehrbuch der organischen Chemie, Verlag Chemie, 3. Auflage, 1957.
- L. Kürti, B. Czakó: Strategic Applications Of Named Reactions In Organic Synthesis. Elsevier Academic Press, USA 2005, S. 182.
- T. Laue, A. Plagens: Namens- und Schlagwortreaktionen der Organischen Chemie. Teubner Verlag, 2006, ISBN 3-8351-0091-2, S. 146–149.
Literatur
- T. Laue, A. Plagens: Namen- und Schlagwort-Reaktionen der Organischen Chemie. (= Teubner Studienbücher Chemie). 3. Auflage. Stuttgart 1998, ISBN 3-519-23526-9.