Asciminib
Asciminib ist ein Arzneistoff mit antineoplastischer Wirkung aus der neuen Wirkstoffgruppe der STAMP-Hemmer. Er wurde im Oktober 2021 in den USA unter dem Namen Scemblix (Novartis) zugelassen zur oralen Behandlung der chronischen myeloischen Leukämie (CML) in der Drittlinientherapie oder bei Vorliegen einer bestimmten Mutation im Philadelphia-Chromosom.[3]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
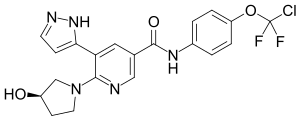 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Asciminib[1] | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C20H18ClF2N5O3 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code |
L01EA06 | |||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 449,84 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Wirkungsmechanismus
STAMP steht für Specifically Targeting the ABL1 Myristoyl Pocket,[4] das bedeutet die selektive Wirkung an der Myristoyl-Bindungstasche der BCR-ABL1-Tyrosinkinase. Die Aktivität dieser Tyrosinkinase ist bei Patienten mit chronisch myeloischer Leukämie (CML) erhöht, wodurch die Proliferation weißer Blutzellen stark zunimmt.[5] Kodiert wird die Tyrosinkinase durch ein BCR-ABL1-Fusionsgen (Philadelphia-Chromosom). Dieses fehlerhafte und verkürzte Chromosom 22 ist bei der klassischen CML und bestimmten Formen akuter Leukämien zu finden.
Anders als bisher eingesetzte Tyrosinkinase-Inhibitoren (Imatinib, Nilotinib, Dasatinib, Bosutinib oder Ponatinib) greift Asciminib nicht an der ATP-Bindungsstelle des BCR-ABL1-Fusionsproteins an. Dadurch wird die Wirkung von Asciminib auch nicht durch bekannte Mutationen der ATP-Bindungsstelle beeinflusst.[6] Vielmehr hemmt Asciminib die ABL1-Kinaseaktivität von BCR-ABL1, indem es an die ABL1-Myristoyltasche bindet. In Studien, die in vitro oder in Tiermodellen der CML durchgeführt wurden, zeigte Asciminib Aktivität sowohl gegen den Wildtyp von BCR-ABL1 als auch gegen mehrere mutierte Formen der Kinase, darunter die T315I-Mutation.[7]
Eigenschaften
Pharmazeutisch verwendet wird der Wirkstoff als Asciminibhydrochlorid,[8] ein weißes bis leicht gelbliches Pulver.[7] Das Arzneimittel kann oral verabreicht werden.
Therapeutische Verwendung
Asciminib ist angezeigt für die Behandlung von erwachsenen Patienten mit folgenden Erkrankungen:
- Philadelphia-Chromosom-positiver chronischer myeloischer Leukämie (Ph+ CML) in der chronischen Phase (CP), die zuvor bereits mit zwei oder mehr Tyrosinkinase-Inhibitoren (TKIs) behandelt wurden.
- Ph+ CML bei Patienten mit einer chronischen myeloischen Leukämie mit der T315I-Mutation.
Nebenwirkungen und Anwendungsbeschränkungen
Die häufigsten Nebenwirkungen, die in den Studien bei 20 Prozent oder mehr der Patienten auftraten, waren Infektionen der oberen Atemwege, Muskel-Skelett-Schmerzen, Müdigkeit, Übelkeit, Hautausschlag und Durchfall.[7] Als häufigste Laboranomalien wurden erniedrigte Zahlen für Thrombozyten und Neutrophile und verminderte Hämoglobinwerte beobachtet, ferner erhöhte Werte für Kreatinkinase, Alanin-Aminotransferase (ALT), Lipase und Amylase, weswegen die Patienten dementsprechend überwacht werden sollen, um gegebenenfalls Maßnahmen einzuleiten.[7]
In Tierversuchen wirkte Asciminib toxisch auf den Fötus. Frauen im fortpflanzungsfähigen Alter sollten auf das mögliche Risiko für den Fötus hingewiesen werden und eine wirksame Empfängnisverhütung anwenden.
Klinische Prüfung
Die FDA-Zulassung von Scemblix basiert auf den Ergebnissen der Phase-3-Studie ASCEMBL und der Phase-1-Studie CABL001X2101:
- In der zulassungsrelevanten multizentrischen, randomisierten, aktiv kontrollierten, offenen Phase-3-Studie ASCEMBL an Patienten mit Ph+ CML-CP, die zuvor mit mindestens zwei anderen TKIs behandelt worden waren,[9] zeigte das Arzneimittel eine signifikante und klinisch bedeutsame Überlegenheit bei der Major Molecular Response (MMR)-Rate gegenüber Bosutinib (25 % vs. 13 %) nach 24 Wochen ( = primärer Endpunkt).[10]
- Ein Therapieabbruch aufgrund von Nebenwirkungen war unter Asciminib seltener als unter Bosutinib (7 % vs. 25 %).[3]
Handelsnamen
Scemblix (USA)
Einzelnachweise
- INN Recommended List 77, World Health Organisation (WHO), 9. März 2017.
- Biomol.com: Asciminib | CAS 1492952-76-7 | Cayman Chemical | Biomol.com, abgerufen am 14. November 2021.
- FDA approves Novartis Scemblix® (asciminib), with novel mechanism of action for the treatment of chronic myeloid leukemia, Pressemitteilung Novartis, 20. Oktober 2021.
- P. Schuld et al.: Structural and Biochemical Studies Confirming the Mechanism of Action of Asciminib, an Agent Specifically Targeting the ABL Myristoyl Pocket (STAMP). Blood, Bd. 136 (Supplement 1), 2020, S. 34–35. doi:10.1182/blood-2020-140968
- G. Geisslinger, S. Menzel, T. Gundermann, B. Hinz, P. Roth (Hrsg.): Mutschler Arzneimittelwirkungen. 11. Auflage. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2020, S. 872 f.
- S. Wedekind: CML: Positive Daten zu STAMP-Inhibitor. Onkologie aktuell, 22. Februar 2021.
- Prescribing Information Scemblix, Novartis Pharmaceuticals, Oktober 2021.
- Externe Identifikatoren von bzw. Datenbank-Links zu Asciminibhydrochlorid: CAS-Nummer: 2119669-71-3, PubChem: 133082086, Wikidata: Q109581935.
- Klinische Studie (Phase 3): Study of Efficacy of CML-CP Patients Treated With ABL001 Versus Bosutinib, Previously Treated With 2 or More TKIs bei Clinicaltrials.gov der NIH
- D. Rea et al.: A Phase 3, Open-Label, Randomized Study of Asciminib, a STAMP Inhibitor, vs Bosutinib in CML After ≥ 2 Prior TKIs. Blood. 2021. DOI: 10.1182/blood.2020009984.
- Klinische Studie (Phase 1): A Phase I Study of Oral ABL001 in Patients With CML or Ph+ ALL bei Clinicaltrials.gov der NIH