Asaron
Unter Asaron fasst man drei in verschiedenen Pflanzen natürlich vorkommende isomere Phenylpropanoide zusammen, die sich in Position und Konfiguration der Doppelbindung in der C3-Seitenkette unterscheiden. Hierzu zählen die 1-propenylischen Verbindungen α-Asaron (trans-Isomer) und β-Asaron (cis-Isomer) sowie das allylische γ-Asaron mit terminaler Doppelbindung in der Seitenkette (2-propenylisch).
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
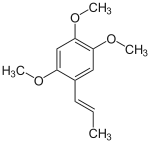 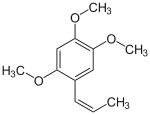 | |||||||||||||||||||
| α-Asaron β-Asaron | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Asaron | ||||||||||||||||||
| Andere Namen |
α-Asaron
β-Asaron
γ-Asaron
| ||||||||||||||||||
| Summenformel | C12H16O3 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 208,25 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest (α-Asaron) | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen

In der Natur kommen α-, β- und γ-Asaron oft vergesellschaftet vor. So enthält das ätherische Öl des Rhizoms der indischen tetraploiden Kalmuspflanze (Acorus calamus) 45–90 % des β-Isomers, 1–2 % des α-Isomers und in Spuren γ-Asaron. Die ätherischen Öle der triploiden europäischen und der diploiden nordamerikanischen Varietät von A. calamus enthalten insgesamt mit maximal 10 % bzw. unter 1 % bedeutend weniger Asarone.[5][6][7][8] γ-Asaron kommt ferner in verschiedenen Pfeffergewächsen vor.[9][10][11]
Verwendung
Asaronhaltige pflanzliche Arzneimittel finden wegen der möglicherweise spasmolytischen Wirkung in der Traditionellen Medizin vieler Ethnien sowie in der Aromatherapie Verwendung.[12][13] Auch bei der Parfümherstellung werden natürliche Riechstoffe verwendet, die Asarone enthalten können. Vor allem in selbstangesetzten oder (mit Kalmus und anderen Pflanzen) aromatisierten Magenbittern und Likören können Asarone enthalten sein.
Toxizität
α- und β-Asaron (i.p.-verabreicht) verursachten Lebertumoren bei männlichen Mäusen[14]. Dabei waren beide Verbindungen vergleichbar (moderat) potent. β-Asaron verursachte weiterhin Leiomyosarkome des Dünndarms (Ratte, oral)[15]. Mutagene Effekte u. a. im Ames-Test mit α- und β-Asaron wurden (nur nach metabolischer Aktivierung) berichtet.[16][17][18] Die Toxizität und insbesondere die Kanzerogenität von γ-Asaron wurden bislang nicht untersucht. Der Wirkmechanismus der Kanzerogenese ist derzeit unbekannt. Asarone werden aber höchstwahrscheinlich nicht wie die strukturverwandten Verbindungen Methyleugenol, Safrol oder Estragol durch Hydroxylierung der Seitenkette (über Cytochrom P450-Enzyme) und anschließende Sulfonierung aktiviert, da die Hemmung der Sulfotransferasen in vivo keinen Einfluss auf die Inzidenzen der Bildung von Hepatomen bei der Maus hatte.[19] α-Asaron zeigte ferner ein gewisses reproduktionstoxisches Potential.[20][21][22]
Regulation
Die Asaron-Isomere konnten bislang nicht ausreichend toxikologisch evaluiert werden. Der gezielte Zusatz von β-Asaron zu Lebensmitteln ist in der Europäischen Union verboten (s. Anhang III der Verordnung (EG) Nr. 1334/2008). In den Vereinigten Staaten ist zudem der gezielte Zusatz von Kalmus in allen Formen zu Lebensmitteln verboten. Für natürliche Gehalte gelten in der EU Höchstmengen von 1,0 mg/kg für alkoholische Getränke.[23] Nach Chemikalienrecht (Verordnung (EG) Nr. 1272/2008 (CLP)) sind α- und β-Asaron als gesundheitsschädlich eingestuft.
Einzelnachweise
- Eintrag zu Asaron. In: Römpp Online. Georg Thieme Verlag, abgerufen am 6. März 2014.
- Fujita u. a.: Yakugaku Zasshi 90 (1970) 1367,1371 und Chem. Abstr. 74 (1971)# 34553.
- Datenblatt Asaron (PDF) bei Carl Roth, abgerufen am 19. Februar 2010.
- Datenblatt Asaron bei Sigma-Aldrich, abgerufen am 9. März 2011 (PDF).
- K. Keller, E. Stahl: Composition of the essential oil from beta-Asarone free calamus. In: Planta Med. 47(2), 1983, S. 71–74.
- T. S. Rana, K. S. Mahar, M. M. Pandey, S. K. Srivastava, A. K. Rawat: Molecular and chemical profiling of 'sweet flag' (Acorus calamus L.) germplasm from India. In: Physiol Mol Biol Plants. 19(2), 2013, S. 231–237. doi:10.1007/s12298-013-0164-8
- P. Satyal, P. Paudel, A. Poudel, N. S. Dosoky, D. M. Moriarity, B. Vogler, W. N. Setzer: Chemical compositions, phytotoxicity, and biological activities of Acorus calamus essential oils from Nepal. In: Nat Prod Commun. 8(8), 2013, S. 1179–1181.
- P. K. Mukherjee, V. Kumar, M. Mal, P. J. Houghton: In vitro acetylcholinesterase inhibitory activity of the essential oil from Acorus calamus and its main constituents. In: Planta Med. 73(3), 2007, S. 283–285.
- W. Qin, S. Huang, C. Li, S. Chen, Z. Peng: Biological activity of the essential oil from the leaves of Piper sarmentosum Roxb. (Piperaceae) and its chemical constituents on Brontispa longissima (Gestro) (Coleoptera: Hispidae). In: Pesticide Biochem Physiol. 2010, S. 132–139, doi:10.1016/j.pestbp.2009.10.006
- K. Matsui, K. Munakata, K. Wada: Insect antifeeding substances in Parabenzoin praecox and Piper futokadzura. In: Agr Biol Chem. 40, 1976, S. 1045–1046.
- T. Masuda, A. Inazumi, Y. Yamada, W. G. Padolina, H. Kikuzaki, N. Nakatani: Antimicrobial phenylpropanoids from Piper sarmentosum. In: Phytochemistry. 30, 1991, S. 3227–3228.
- Eliane Zimmermann: Aromatherapie für Pflege- und Heilberufe. Georg Thieme Verlag, 2006, ISBN 3-8304-9114-X.
- P. K. Mukherjee, V. Kumar, M. Mal, P. J. Houghton: In vitro acetylcholinesterase inhibitory activity of the essential oil from Acorus calamus and its main constituents. In: Planta Med. 73(3), 2007, S. 283–285.
- R. W. Wiseman, E. C. Miller, J. A. Miller, A. Liem: Structure-activity studies of the hepatocarcinogenicities of alkenylbenzene derivatives related to estragole and safrole on administration to preweanling male C57BL/6J x C3H/HeJ F1 mice. In: Cancer Res. 47(9), 1987, S. 2275–2283.
- Joint FAO/WHO Expert Committee on Food Additives (JECFA), Monograph für β-Asarone, abgerufen am 9. Dezember 2014.
- W. Göggelmann, O. Schimmer: Mutagenicity testing of beta-asarone and commercial calamus drugs with Salmonella typhimurium. In: Mutat Res. 121, 1983, S. 191–194.
- G. Abel, W. Göggelmann: Genotoxic activity of β-asarone and commercial calamus drugs. In: Mutat Res/Environ Mutagen. 164, 4, 1986, S. 287.
- B. O. Mohar, C. Espinoza-Aguirre, G. Cortinas dew NavChamorro: Determinación de la actividad mutagénica de alpha-asarona en ei sistema Salmonella typhimurium/ microsomas. In: Proceedings of 1st Congress of the Mexican Association of Mutagenesis, Carcinogenesis and Teratogenesis. 1986; referenziert In: P. Morales-Ramírez, E. Madrigal-Bujaidar, J. Mercader-Martínez, M. Cassini, G. González, G. Chamorro-Cevallos, M. Salazar-Jacobo: Sister-chromatid exchange induction produced by in vivo and in vitro exposure to alpha-asarone. In: Mutat Res. 279, 1992, S. 269–273.
- R. W. Wiseman, E. C. Miller, J. A. Miller, A. Liem: Structure-activity studies of the hepatocarcinogenicities of alkenylbenzene derivatives related to estragole and safrole on administration to preweanling male C57BL/6J x C3H/HeJ F1 mice. In: Cancer Res. 47(9), 1987, S. 2275–2283.
- Joint FAO/WHO Expert Committee on Food Additives (JECFA), Monograph für β-Asarone, abgerufen am 9. Dezember 2014.
- M. Salazar, S. Salazar, V. Ulloa, T. Mendoza, N. Pages, G. Chamoro: Teratogenic action of alpha-asarone in the mouse. In: J Toxicol Clin Exp. 12, 3, 1992, S. 149–154.
- G. Chamorro, L. Garduño, E. Martínez, E. Madrigal, J. Tamariz, M. Salazar: Dominant lethal study of alpha-asarone in male mice. In: Toxicol Lett. 99, 2, 1998, S. 71–77.
- Verordnung (EG) 1334/2008.
Weblinks
- Eintrag im Riechstofflexikon (Memento vom 7. Mai 2012 im Internet Archive)
- Kalmus-Pflanze
