Aluminiumchlorat
Aluminiumchlorat ist ein Aluminiumsalz der Chlorsäure mit der Summenformel Al(ClO3)3, das als Arzneistoff verwendet wurde.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
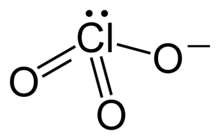 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Aluminiumchlorat | ||||||||||||||||||
| Summenformel | Al(ClO3)3 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 277,33 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt |
Zersetzung[1] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Darstellung und Verwendung
In wässriger Lösung wird das Aluminiumchlorat durch Umsetzung von Bariumchlorat mit Aluminiumsulfat hergestellt, wobei das schwerlösliche Bariumsulfat ausfällt:
Die Substanz wurde daraus nicht isoliert, sondern die Lösung weiterverarbeitet. 25%ige Aluminiumchloratlösung wurde früher medizinisch als adstringierend, antiseptisch und antimikrobiell wirkende Flüssigkeit[3] zur Mundspülung[4], Blutstillung und Behandlung von Wunden und Geschwüren verwendet.[5] Der Einsatz als Antiseptikum beruht auf der irrigen Vorstellung, dass Chlorate Sauerstoff abspalten würden, der dann Bakterien töten würde. Die Verwendung von Aluminiumchlorat wurde inzwischen wegen der beträchtlichen Toxizität von Chloraten und deren Unwirksamkeit als Antiseptika aufgegeben.[6] Heutige Adstringentien verwendet Aluminiumchlorid oder Kaliumaluminiumsulfat anstelle des Alminiumchlorats.[7]
Eigenschaften
Aluminiumchlorat bildet farblose, in Wasser gut lösliche Kristalle, die sich leicht beim Erhitzen und längerer Lagerung über 35 °C zu Aluminiumchlorid und Sauerstoff zersetzen. Bekannt sind das Hexahydrat Al(ClO3)3 · 6 H2O und das Nonahydrat Al(ClO3)3 · 9 H2O; letzteres bildet sich beim vorsichtigen Eindampfen aus wässriger Lösung.[1] Wie alle Chlorate ist auch Aluminiumchlorat ein starkes Oxidationsmittel, das mit brennbaren Stoffen explosionsartig reagieren kann.
Einzelnachweise
- Dale L. Perry, Sidney L. Phillips. Handbook of Inorganic Compounds, 1995, CRC Press, ISBN 0849386713.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- leo-bw.de: Friedrich Mallebrein, abgerufen am 4. Januar 2015.
- Friedrich Mallebrein: Deutsch: Diese wissenschaftliche Veröffentlichung von Friedrich Mallebrein und C. Wasmer ist die Grundlage für die Erfindung des Medikaments Mallebrin. Auf der Suche nach Behandlungen für Tuberkulose entdecken Mallebrein und Wasmer interessante Wirkungen von Aluminiumchlorat gegen Beschwerden im Mund- und Rachenraum. Die Arbeit erschien in der Zeitschrift für Tuberkulose. Bd. 18, H. 3, 1912. 1912, abgerufen am 7. Dezember 2021.
- Franz von Bruchhausen: Hagers Handbuch der pharmazeutischen Praxis, S. 141, 1997, Springer Verlag, ISBN 3540526889.
- Harry Auterhoff, Lehrbuch der pharmazeutischen Chemie, Wissenschaftliche Verlagsgesellschaft Stuttgart, 1968
- Mallebrin® – Mundgesundheit bis in den Rachen (Memento vom 2. Februar 2019 im Internet Archive)