Alkenylbernsteinsäureanhydride
Alkenylbernsteinsäureanhydride (engl. alkenyl succinic anhydrides ASA) leiten sich ab von dem fünfgliedrigen Ringsystem des Bernsteinsäureanhydrids (Dihydrofuran-2,5-dions bzw. Oxolan-2,5-dion), das in 2-Stellung einen langkettigen (C14 bis C22) verzweigten iso-Alken-Rest trägt. Die flüssigen Verbindungen werden vielfältig eingesetzt, insbesondere in der Oberflächen- und Masseleimung – auch bezeichnet als Schlichtung (engl. sizing) oder Leimung – von Papier, Pappe und Karton, sowie in der Hydrophobierung von Cellulosefasern. Die damit behandelten Erzeugnisse weisen verringerte Penetration wässriger Medien, wie z. B. Tinte, Druckfarbe oder auch Getränken, wie Milch oder Fruchtsäften auf.
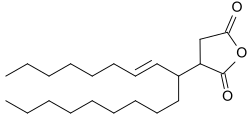
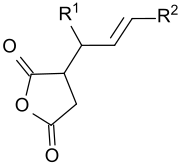
In den USA haben sich inzwischen Alkenylbernsteinsäureanhydride als die bevorzugten Papierleimungsmittel etabliert, während in Europa der Gebrauch von Alkylketendimeren (AKD) überwiegt.
Geschichte
Die Reaktion von Maleinsäureanhydrid (MAN) mit aliphatischen einfach ungesättigten n- und iso-Alkenen im so genannten "cracked distillate" – einer beim Cracken von Erdöl anfallenden Destillatfraktion mit hohem Anteil an ungesättigten Kohlenwasserstoffen – wurde bereits 1936 in einem Patent beschrieben.[1]
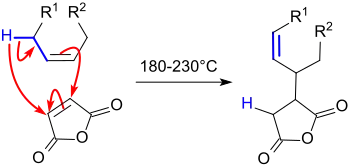
Darin wurden die Olefine im Überschuss mit Maleinsäureanhydrid bei 200 °C im Autoklaven zur Reaktion gebracht, anschließend das überschüssige Alken im Vakuum abdestilliert, das erhaltene Alkenylbernsteinsäureanhydrid mit verdünnter Natronlauge hydrolysiert und das Dinatriumsalz mit Säure zur Alkenylbernsteinsäure umgesetzt. Unter den "many useful applications" der erhaltenen Produkte wurde die Anwendung als Schlichte allerdings noch nicht erwähnt.
Mit einem vorgereinigten "cracked petroleum distillate" wurden bei 210 °C im Autoklaven 30 % höhere Reaktionsausbeuten erzielt und festgestellt, dass sich die Hydrolyse des Bernsteinsäureanhydrids bereits mit Wasserdampf durchführen lässt.[2]
Während bei den frühen technischen Verwendungen als Schmierstoffe und Rostschutzmittel die dunkelbraune Farbe und schwarzen, teerartigen Polymerrückstände in den nach damaligen Prozessen hergestellten Alkenylbernsteinsäureanhydriden geringe Bedeutung hatten, wurden für den späteren Einsatz in Reinigern und Waschmitteln klare, d. h. polymerfreie, und weniger dunkel gefärbte ASA benötigt.
Die erstmals 1959 patentierte Verwendung von Alkenylbernsteinsäureanhydriden zur wasserabweisenden Ausrüstung von cellulosebasierten (Baumwoll)-Textilien[3] und die Übertragung dieses Konzepts auf die Hydrophobierung von Papier mittels iso-Octadecenylbernsteinsäureanhydriden (C18-ASA) im Jahr 1963[4][5] erforderte die Bereitstellung flüssiger, partikelfreier und möglichst heller ASA-Varianten.
Nach anfänglichen Schwierigkeiten bei dem Einsatz von ASA zur Papierleimung, besonders die schnelle Hydrolyse zu Alkenylbernsteinsäuren, die Bildung schwerlöslicher Calciumsalze in hartem Wasser und Ablagerungen in der Papiermaschine,
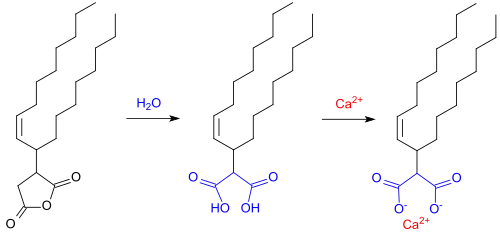
konnten die Prozessparameter so angepasst werden, dass sich Alkenylbernsteinsäureanhydride in den USA als derzeit wichtigste Schlichtemittel etablieren konnten.
Herstellung
Bei der En-Reaktion von Alkenen mit Maleinsäureanhydrid bei hohen Temperaturen (>200 °C) werden durch Konkurrenzreaktionen, wie z. B. Oxidation, Kondensation und (alternierende Co-)Polymerisation, unerwünschte Folgeprodukte gebildet, die die Ausbeute an ASA reduzieren und Farbe, Konsistenz und Verarbeitbarkeit der Endprodukte negativ beeinflussen.
Die aus unverzweigten 1-Alkenen erhaltenen und bei Raumtemperatur festen 1-Alkenylbernsteinsäureanhydride[6] eignen sich nicht zur Masseleimung aus wässriger Emulsion.[7]
Die nach dem so genannten SHOP-Verfahren durch Oligomerisierung von Ethylen zugänglichen geradzahligen 1-Alkene CH2=CH-(CH2)n-CH3 mit endständigen Doppelbindungen werden an Magnesiumoxid-Katalysatoren unter Verschiebung der Doppelbindung in innere Positionen entlang der Kohlenstoffkette isomerisiert und durch fraktionierte Destillation in die gewünschten Schnitte innerhalb der für ASA bevorzugten C14 – C22-Fraktion aufgetrennt.

Die Herstellung der Alkenylbernsteinsäureanhydride erfolgt mit einem Überschuss an iso-Alken bei Temperaturen > 200 °C unter Stickstoff für mehr als 3 Stunden; das überschüssige iso-Alken wird unter vermindertem Druck abdestilliert.
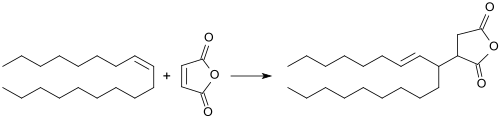
Zu Verfahren zur Unterdrückung der Nebenreaktionen bei der Herstellung von ASA aus iso-Alkenen und MAN liegt umfangreiche Patentliteratur vor. So kann durch Zusatz von Antioxidantien bzw. Polymerisationsinhibitoren, wie z. B. Hydrochinon oder Phenothiazin die Polymerbildung verringert und das Maleinsäureanhydrid quantitativ umgesetzt werden.[8] Später gelang es auch, z. B. durch Waschen mit Wasser die Farbe der bei der Reaktion von 1-Alkenen mit Maleinsäureanhydrid erhaltenen festen ASA von dunkelbraun auf bernsteinfarben zu verbessern.[9] Durch Kombination eines Reduktionsmittels, wie z. B. eines Trialkylphosphits mit einem phenolischen Antioxidans wird eine wesentliche Aufhellung und Verringerung der Teerbildung erzielt.[10]
Dass die Probleme der Verfärbung und Teerbildung bei der ASA-Synthese weiterhin nur unzureichend gelöst sind, zeigen neuere Patente, die z. B. ein sterisch gehindertes Phenol (BHT als primäres Antioxidans), einen Thioether (als sekundäres Antioxidans) und N,N′-Disalicyliden-1,2-diaminopropan als Deaktivator für Metallionen in einer „synergistischen Mischung“ einsetzen.[11] Das aus Dodecen und MAN nach sechs Stunden bei 220 °C gebildete C12-ASA ist hellgelb gefärbt und enthält aber immer noch erhebliche Mengen an schwarzen, teerartigen Zersetzungsprodukten.
Eine dramatische Verbesserung (um 600 %) in der Leimungseffizienz wird bei Alkenylbernsteinsäureanhydriden gefunden, die auf symmetrischen Alkenen, wie z. B. dem C22-Alken 11-Docosen (durch Alkenmetathese aus 1-Dodecen), beruhen.[12]
Verwendung
Alkenylbernsteinsäureanhydride – und die daraus durch Hydrolyse zugänglichen Alkenylbernsteinsäuren – finden aufgrund ihrer reaktiven und grenzflächenaktiven Eigenschaften u. a. Verwendung als Härter für Epoxidharze, als Korrosionsinhibitoren in Schmierölen, als Reaktand in Alkydharzen und ungesättigten Polyesterharzen, als Additiv in Motoröl und Treibstoffen, als Komponenten in Weichmachern, als Zusätze in Tonerharzen, als Tenside, als wasserbindende und feuchtigkeitskontrollierende Additive, als Metallreiniger und als chemische Zwischenprodukte.
Die mengenmäßig mit Abstand wichtigste Verwendung von Alkenylbernsteinsäureanhydriden ist die Oberflächen- und Masseleimung von Papier, Pappe und Karton mit einem globalen Verbrauch in 2005 von ca. 47,000 Tonnen.[13]
Alkenylbernsteinsäureanhydride als Papierleimungsmittel
Auf die in den 1950er Jahren als Hydrophobisierungsmittel für cellulosebasierte Erzeugnisse eingeführten festen Alkylketendimeren (AKD)[14] folgten in den 1960er Jahren die flüssigen Alkenylbernsteinsäureanhydride. Beide Substanzklassen sind hydrophob und daher praktisch wasserunlöslich – die Löslichkeit der Standardverbindung iso-Octadecenylbernsteinsäureanhydrid C18-ASA beträgt nur 5,33 × 10−5 mgl−1. Wegen ihrer kürzeren Kettenlänge sind ASA weniger hydrophob und somit weniger wasserabweisend als AKD. Ihr Dampfdruck ist höher als der von AKD, wodurch es schneller in und durch die Papierschicht diffundiert, aber auch Ablagerungen auf Maschinenabdeckungen bildet. AKD liegen bei Raumtemperatur in Wasser als Dispersionen, ASA dagegen als Öl-in-Wasser-Emulsionen vor. Der wichtigste Unterschied liegt jedoch in der wesentlich höheren Reaktivität der cyclischen Carbonsäureanhydrid-Struktur in den ASA im Vergleich zur Diketen-Struktur bei AKD. Damit einher geht auch die sehr viel schnellere Hydrolyse im wässrigen, insbesondere alkalischen Medium.[15] Daher müssen Alkenylbernsteinsäureanhydride unmittelbar vor ihrem Einsatz an der Papiermaschine in eine Emulsion überführt werden, während AKD als stabile Emulsion angeliefert und gelagert werden können.
ASA-Emulsionen werden wie AKD-Dispersionen mit Polykationen als Schutzkolloide und Retentionshilfsmittel, insbesondere mit kationischer Stärke[16] oder kationischen Polyacrylamiden (C-PAM) im Verhältnis ASA zu Kation von ca. 2:1, sowie mit ca. 1 % anionischen oder nichtionischen Tensiden durch hohe Scherung in einer optimalen Partikelgröße von ca. 1 μm hergestellt.
Zu den Vorteilen der Verwendung von ASA zur Papierleimung zählen:[13]
- Anwendbarkeit im neutralen bis schwach alkalischen pH-Bereich (optimal pH 6–8) – AKD sogar pH 5–9)
- Hohe Reaktivität führt zur Hydrophobierung bereits im so genannten wet end des Papierprozesses – AKD behandelte Papiere müssen eine Zeit lang reifen
- Hydrophobisierungsgrad leicht einstellbar – nicht bei AKD
- Geringere Dosierung bei ASA (0,1 %, bezogen auf Papiermasse) als bei AKD (0,2 %)
- Kaum Einfluss auf Papiereigenschaften – AKD können bei hoher Dosierung zu klebrigen Papieroberflächen führen
- Gute Oberflächenleimung
- Hohe Alterungsbeständigkeit des behandelten Papiers
Die Nachteile von ASA sind insbesondere:
- Schnelle Hydrolyse des AKD nach Herstellung der Emulsion → sehr geringe Lagerstabilität
- Emulsionsherstellung erst an der Papiermaschine mit hohen Investitions- und Betriebskosten
- Gefahr der Bildung klebriger Ablagerungen in der Maschine
- Ölige Abscheidungen im Trocknerbereich
Schnellere Reaktion und geringere Einsatzmengen (und damit Materialkosten in einem der kostenintensivsten Teilschritte der Papierherstellung) sprechen für die Verwendung von ASA, während AKD eine nachhaltigere Hydrophobierung und bessere Haftung in Materialverbunden mit z. B. Polyethylenfolien für wasser- und säurefeste Getränkeverpackungen bewirken.
Papierleimung mit Alkenylbernsteinsäureanhydriden
Die Papierleimung mit ASA verläuft im Wesentlichen wie mit AKD formal in drei Schritten
- der Retention bzw. Fixierung der ASA-Emulsionströpfchen auf der feuchten Papiermasse
- dem Aufbrechen der Emulsionströpfchen mit der Spreitung auf der Oberfläche und dem Eindringen in die Papiermasse
- die Ausbildung einer hydrophoben Papieroberfläche mit Kontaktwinkeln > 100° durch kovalente Verknüpfung (Veresterung) der ASA-Moleküle mit den Hydroxygruppen der Cellulose
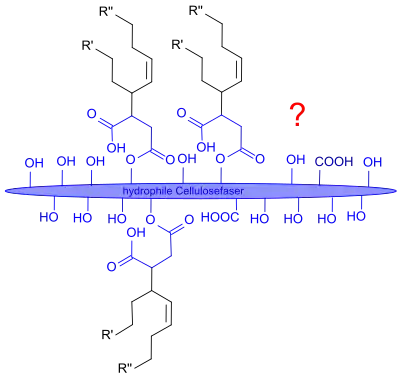
Bereits in den 1990er Jahren von japanischen Autoren publizierte Untersuchungen wecken erhebliche Zweifel an dieser idealisierten Darstellung der Hydrophobierung von Cellulosefaseroberflächen. So konnte nachgewiesen werden, dass kein oder nur sehr wenig ASA über kovalente Esterbindungen an Cellulose gebunden wird.[17]
Dies legt die Vermutung nahe, dass die durch ASA bewirkte Hydrophobierung eher auf einer adsorptiven und assoziativen Interaktion der durch rasche Hydrolyse im wässrigen Medium gebildeten Alkenylbernsteinsäuren mit den Bestandteilen der Papiermasse (Cellulosefasern, Füllstoffe, wie z. B. Calciumcarbonat als PCC (engl. precipitated calcium carbonate) oder kationische Polymere) beruht, wobei bereits geringe (< 0,15 %) Mengen (Zitat M.A. Hubbe: "It doesn't take much") und auch inhomogene Verteilung ("It doesn't have to be uniform") für einen hohen Grad an Hydrophobie ausreichen.
Die Verschiebung der Papierrohstoffbasis zu Recyclingmaterial – den so genannten sekundären Fasern – der rasante Anstieg der Volumina von Pappe und Karton zu Lasten von Druckpapier, die wachsenden Geschwindigkeiten (> 120 km/h[13]) und Produktionsmengen (max. Tageskapazität einer einzelnen Maschine > 4,500 Tonnen bzw. > 1,5 Millionen Tonnen pro Jahr)[18] stellen die Weiterentwicklung von ASA-basierten Leimungsmitteln für Cellulose und ihrer Rezepturen vor enorme Herausforderungen, auch angesichts des noch stark von Empirie gestützten Verständnisses der grundlegenden Prozesse der Hydrophobierung von Cellulosefasern.
Literatur
- M.A. Hubbe: Acidic and Alkaline Sizings for Printing, Writing, and Drawing Papers. Hrsg.: G. Edwards. The Book and Paper Group Annual 23, Charlottesville, VA, USA 2004, S. 139–151 (ncsu.edu).
- P. Bajpai: Pulp and Paper Chemicals, 1st edit. Elsevier, Amsterdam 2015, ISBN 978-0-12-803408-8.
- T. Arnson et al.: The Sizing of Paper, 3rd edit. Hrsg.: J.M. Gess, J.M. Rodriguez. TAPPI Press, Atlanta, GA, USA 2005, ISBN 1-59510-073-3.
- M.A. Hubbe: Paper's Resistance to Water – A Review of Internal Sizing Chemicals and their Effects. In: BioResources. Band 2, Nr. 1, 2006, S. 106–145 (ncsu.edu).
- C. Hagiopol, J.W. Johnston: Chemistry of Modern Papermaking. CRC Press, Boca Raton, FL, GA, USA 2011, ISBN 978-1-4398-5646-8.
Einzelnachweise
- Patent US2055456: Process and product relating to olefin derivatives. Angemeldet am 6. Oktober 1931, veröffentlicht am 22. September 1936, Anmelder: Shell Development Co., Erfinder: E. Eichwald.
- Patent US2230005: Process for the production of valuable products from cracked petroleum distillates. Angemeldet am 4. Januar 1938, veröffentlicht am 28. Januar 1941, Anmelder: Shell Development Co., Erfinder: F.R. Moser.
- Patent US2903382: Treatment of fabric with alkenylsuccinic acids and anhydrides to impart water repellency. Angemeldet am 23. Juni 1958, veröffentlicht am 8. September 1959, Anmelder: Armour and Co., Erfinder: R.J. Berls.
- Patent US3102064: Novel paper sizing process. Angemeldet am 8. September 1961, veröffentlicht am 27. August 1963, Anmelder: National Starch and Chemical Corp., Erfinder: O.B. Wurzburg, E.D. Mazzarella.
- Patent US3821069: Process of sizing paper with a reaction product of maleic anhydride and an internal olefin. Angemeldet am 2. Januar 1973, veröffentlicht am 28. Juni 1974, Anmelder: National Starch and Chemical Corp., Erfinder: O.B. Wurzburg.
- P.B. Sellars, L. Lue, I.S. Burns, D.N. Work: Freezing properties of alkenyl succinic anhydrides derived from linear isomerized olefins. In: Ind. Eng. Chem. Res. Band 55, Nr. 8, 2016, S. 2287–2292, doi:10.1021/acs.iecr.5b04769.
- Patent US5104486: Alkenyl succinic anhydride compositions. Angemeldet am 27. Februar 1987, veröffentlicht am 14. April 1992, Anmelder: Chevron Research Co., Erfinder: W.A. Sweeney.
- Patent US3412111: Process for reacting an olefin with maleic anhydride to obtain an alkenyl succinic anhydride. Angemeldet am 2. Juni 1965, veröffentlicht am 19. November 1968, Anmelder: Gulf Research & Development Co., Erfinder: P.G. Irwin, C.M. Selwitz.
- Patent US4158664: Process for improving color of certain alkenyl succinic ahydrides. Angemeldet am 17. Juni 1977, veröffentlicht am 19. Juni 1979, Anmelder: Gulf Research & Development Co., Erfinder: C.M. Selwitz, H.I. Thayer.
- Patent US5021169: Alkenyl succinic anhydrides process. Angemeldet am 13. November 1989, veröffentlicht am 4. Juni 1991, Anmelder: Ethyl Corp., Erfinder: K.-H. Shin, P.S. Hale.
- Patent US8350058B2: Method for producing alkenyl succinic anhydrides. Angemeldet am 3. Dezember 2005, veröffentlicht am 8. Januar 2013, Anmelder: Clariant Produkte (Deutschland) GmbH, Erfinder: D. Leinweber, T. Rau.
- Patent US7455751B2: Use of alkenyl succinic anhydride compounds derived from symmetrical olefins in internal sizing for paper production. Angemeldet am 15. April 2005, veröffentlicht am 25. November 2008, Anmelder: Nalco Co., Erfinder: W.J. Ward, K. Andruszkiewicz, R.T. Gray, T.P. McGinnis, R.W. Novak.
- S. Porkert: Physico-chemical processes during reactive paper sizing with alkenyl succinic anhydride (ASA). Technische Universität Dresden, 2016, urn:nbn:de:bsz:14-qucosa-219620 (Dissertation).
- Patent US2627477: Higher alkyl ketene dimer emulsion. Angemeldet am 6. Oktober 1949, veröffentlicht am 3. Februar 1953, Anmelder: Hercules Powder Co., Erfinder: W.F. Downey.
- J. Lindfors, J. Salmi, J. Laine, P. Stenius: AKD and ASA model surfaces: Preparation and characterization. In: BioResources. Band 2, 2007, S. 652–670 (ncsu.edu).
- Patent US5606773: Emulsification of alkenyl succinic anhydride sizing agents. Angemeldet am 10. Dezember 1984, veröffentlicht am 19. August 1986, Anmelder: Nalco Chemical Co., Erfinder: R.W. Novak.
- E. Martorana, J. Belle, S. Kleemann: ASA optimization – Control of particle size, stability and hydrolysis. In: Professional Papermaking. Band 5, Nr. 2, 2008, S. 34–42, urn:nbn:de:bvb:m347-opus-172.
- PM 2- die größte Papiermaschine der Welt. In: Voith Paper. Band 31, 2010, S. 16–19 (blogus.de [PDF]).