Zoledronsäure
Zoledronsäure (auch: Zoledronat) ist ein Arzneistoff, der den Abbau von Knochengewebe hemmt. Er wird in der Behandlung von Erkrankungen des Skeletts wie Osteoporose und der Paget-Krankheit verwendet. Auch zur Vorbeugung gegen Knochenkomplikationen bei Krebspatienten, deren Erkrankung die Knochen beeinträchtigt und zur Behandlung von tumorbedingten, zu hohen Calciumspiegeln im Blut ist Zoledronsäure angezeigt.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
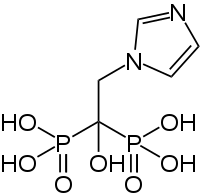 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Zoledronsäure | |||||||||||||||
| Andere Namen |
[1-Hydroxy-2-(imidazol-1-yl)ethyliden]diphosphonsäure (IUPAC) | |||||||||||||||
| Summenformel |
| |||||||||||||||
| Kurzbeschreibung |
weißes kristallines Pulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code |
M05BA08 | |||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | ||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Chemisch handelt es sich um eine Substanz aus der Gruppe der Bisphosphonate. Zoledronsäure wurde von Novartis entwickelt.
Wirkungsmechanismus
Durch Zoledronsäure wird der Knochenabbau vermindert, indem die Osteoklasten gehemmt werden. Die Osteoklasten sind für die Resorption der Knochensubstanz verantwortlich.
Klinische Angaben
Anwendungsgebiete und Art der Anwendung
- Zometa
Als Zometa ist Zoledronsäure seit 2003 zugelassen zur Behandlung der tumorinduzierten Hyperkalzämie (TIH) und zur Prävention skelettbezogener Komplikationen bei Patienten mit fortgeschrittenen, auf das Skelett ausgedehnten Tumorerkrankungen. Neben der Inhibition der Knochenresorption wurde in klinischen Studien verschiedene Anti-Tumor-Aktivitäten nachgewiesen, die zur Gesamtwirkung beitragen könnten. Durch die Hemmung der Resorption wird die Anfälligkeit des Knochenmarks für das Wachstum von Tumorzellen vermindert, außerdem wurden anti-angiogenetische und analgetische Effekte beobachtet. In vitro wurde unter anderem eine direkte zytostatische Aktivität auf Tumorzellen festgestellt.[4]
Zometa wird üblicherweise drei- bis vierwöchentlich als intravenöse Infusion verabreicht.
- Aclasta
Als Aclasta ist Zoledronsäure seit 2005 zugelassen zur Behandlung der Osteodystrophia deformans (Morbus Paget) und seit 2007 zur Behandlung der postmenopausalen Osteoporose bei Frauen. Die Osteodystrophia deformans ist nach Osteoporose die zweithäufigste Erkrankung des Knochenstoffwechsels. Sie äußert sich durch die Verdickung und Deformierung von Knochen und eine verminderte Bruchfestigkeit. Die Ursache ist nicht abschließend geklärt – man nimmt virale Infektionen oder genetische Faktoren an.
In der 2007 veröffentlichten HORIZON-PFT-Studie mit 7765 Patientinnen mit postmenopausaler Osteoporose konnte über drei Jahre unter Zoledronsäure 5 mg das relative Risiko für Wirbelkörperfrakturen im Vergleich mit Placebo um 70 % und das Risiko für Hüftfrakturen um 41 % reduziert werden.[5]
2008 wurde die Zulassung erweitert um die Behandlung von Männern mit osteoporosebedingtem Frakturrisiko. Die Zulassungserweiterung umfasst auch die Reduktion von Frakturen bei Männern und postmenopausalen Frauen, welche kürzlich eine osteoporosebedingte Hüftfraktur erlitten haben. Letztgenannte Indikationserweiterung stützt sich auf eine klinische Studie mit 2100 Patienten. Gemäß diesen Studiendaten kann das Risiko für eine erneute Fraktur um 35 % gesenkt werden.[6][7]
2009 wurde das Anwendungsgebiet erweitert auf die Behandlung von Patienten, deren Osteoporose im Zusammenhang mit einer Langzeitbehandlung mit Glucocorticoiden steht.
Aclasta wird im Gegensatz zu anderen Bisphosphonaten einmal jährlich als intravenöse Infusion – und nicht wie sonst üblich in Form von wöchentlicher Tabletteneinnahme – verabreicht. Eine Durchstechflasche Aclasta enthält 5 Milligramm Wirkstoff in 100 ml Wasser für Injektionszwecke.
Nebenwirkungen
Die Nebenwirkungen von Zoledronsäure sind vergleichbar mit denen anderer intravenös verabreichter Bisphosphonate. Sie treten in der Regel innerhalb der ersten Tage nach der Einnahme auf und klingen innerhalb weniger Tage wieder ab. Als häufigste Nebenwirkungen sind grippeähnliche Symptome und Kopfschmerzen zu beobachten. Außerdem kann es in Einzelfällen zu Fieber, Knochen- und Gelenkschmerzen, Müdigkeit, Magen-Darm-Beschwerden kommen. Laut HORIZON-Studie trat bei Behandlung mit Zoledronsäure bei nicht wenigen Patientinnen (1,3 %) auch Vorhofflimmern auf, das bisher bei Bisphosphonaten nicht beobachtet worden war.[8] Das Vorhofflimmern lag unter der für diese Altersgruppe zu erwartenden Rate und wurde in anderen Studien mit Zoledronsäure nicht beobachtet.
Seit 2003 wird das Auftreten von Kiefernekrosen nach Zahnextraktion in Verbindung mit der Gabe von Aminobisphosphonaten beschrieben. Kiefernekrosen treten fast ausschließlich in Verbindung mit der Gabe von Zoledronsäure auf. Im Bereich einer westdeutschen Großstadt mit 250.000 Einwohnern und einem Einzugsgebiet von 1 Million wurden insgesamt 169 Patienten dreier onkologischer Schwerpunktpraxen sowie der beteiligten Fachklinika einer Universitätsklinik untersucht. (…) Insgesamt konnten bei 15 Patienten (9 %) bisphosphonatassoziierte Kiefernekrosen gefunden werden. Das am häufigsten verwendete Aminobisphosphonat war Zoledronsäure. 47 % der Patienten erhielten dies isoliert, bei weiteren 20 % war Zoledronsäure im Wechsel mit anderen Bisphosphonaten gegeben worden. 13 % hatten Aredia, 20 % Bondronat erhalten. Kiefernekrosen entstanden zu je 50 % nach Zahnextraktion oder spontan. Meist war der Unterkiefer betroffen, in 20 % Ober- und Unterkiefer.[9] Eine Zahnsanierung vor der Behandlung und eine Verlängerung der Dosierungsintervalle könnten nach den Ergebnissen einer Beobachtungsstudie in JAMA Oncology das Risiko senken.[10]
Wegen des Auftretens bzw. der Verschlechterung von Nierenfunktionsstörungen unter Zoledronsäure wurden Patienten mit schlechter Nierenfunktion im März 2010 von der Behandlung mit Aclasta ausgeschlossen.[11] Die Food and Drug Administration erweiterte für ihren Bereich (USA) die Warnung bzw. das Verbot im September 2011.[12]
Handelsnamen
Aclasta (D, A, CH), Reclast (USA), Zoledro-Denk (D), Zometa (D, A, CH)
Kombinationspräparate
Aszora Trio (D)
Literatur
- Kenneth W. Lyles et al.: Zoledronic Acid and Clinical Fractures and Mortality after Hip Fracture. In: NEJM. November 2007, doi:10.1056/NEJMoa074941 (englisch).
- Ian R. Reid et al.: Fracture Prevention with Zoledronate in Older Women with Osteopenia. In: NEJM. Oktober 2018, doi:10.1056/NEJMoa1808082 (englisch).
Weblinks
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Zoledronsäure
Einzelnachweise
- FDA - Full prescribing information for Zometa® (PDF; 221 kB).
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 1753–1754, ISBN 978-0-911910-00-1.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Fachinformation Zometa®, Juli 2009.
- Black et al. Once-Yearly Zoledronic Acid for Treatment of Postmenopausal Osteoporosis. NEJM 2007;356;18;1809-1822. Abstract PMID 17476007.
- Once-yearly Aclasta® approved in EU to treat osteoporosis in men and to reduce risk of new fractures following hip fracture both in men and postmenopausal women Novartis Pressemitteilung vom 30. September 2008 (PDF; 96 kB).
- Lyles KW et al.: Zoledronic acid and clinical fractures and mortality after hip fracture. N Engl J Med. 2007 Nov 1;357(18):1799-809. Epub 2007 Sep 17. Volltext (HTML)Volltext (PDF), PMID 17878149.
- Ergebnis der randomisierten HORIZON-Studie veröffentlicht im New England Journal of Medicine (NEJM 2007; 356:1809-1822), hier zitiert nach: Deutsches Ärzteblatt, 3. Mai 2007 (online (Memento vom 3. April 2015 im Internet Archive)).
- Gerhards F., Rana M., Maciejewski O., Smeets R.: Prospektive Kohortenstudie zu möglichen Kofaktoren der bisphosphonatassoziierten Kiefernekrosen; 59. Jahrestagung der Arbeitsgemeinschaft für Kieferchirurgie, Wiesbaden (21.-23. Mai 2009).
- Catherine H. Van Poznak, Joseph M. Unger u. a.: Association of Osteonecrosis of the Jaw With Zoledronic Acid Treatment for Bone Metastases in Patients With Cancer. In: JAMA Oncology. , doi:10.1001/jamaoncol.2020.6353.
- Rote Hand-Brief der Firma Novartis, 12. März 2010.
- Neue Kontraindikation und Warnhinweis für Zoledronsäure (Memento vom 22. Februar 2014 im Internet Archive) Ausführliche Darlegung.