Zinkchlorat
Zinkchlorat ist eine anorganische chemische Verbindung des Zinks aus der Gruppe der Chlorate.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
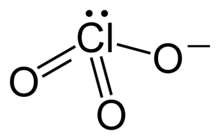 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Zinkchlorat | |||||||||||||||
| Summenformel | Zn(ClO3)2 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 232,29 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Dichte |
2,15 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
leicht in Wasser (2620 g·l−1 bei 20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Zinkchlorat kann durch Reaktion von Zinksulfat mit Bariumchlorat gewonnen werden. Das Bariumsulfat fällt dabei als schwerlösliches Salz aus, das Zinkchlorat bleibt in Lösung.[4]
Eigenschaften
Zinkchlorat ist ein farbloser[1] hygroskopischer Feststoff[2]. Aus wässrigen Lösungen von Zinkchlorat kristallisieren, je nach der Konzentration und der Temperatur der Lösungen, die Verbindungen Zn(ClO3)2·12 H2O (Schmelztemperatur −24,9 °C), Zn(ClO3)2·6 H2O (16,4 °C), Zn(ClO3)2·4 H2O (53,9 °C) und Zn(ClO3)2·2 H2O. Das Dihydrat schmilzt bei 114 °C und beginnt sich aber gleichzeitig unter Abspaltung von Chlordioxid zu zersetzen. In dem System treten sechs Quadrupelpunkte auf, von denen zwei in Gebieten liegen, in denen die betreffenden Hydrate instabil bzw. metastabil sind.[5]
Verwendung
Zinkchlorat wird als Katalysator[1], Bleichmittel und Bestandteil von Explosivstoffen verwendet.[4]
Einzelnachweise
- New Jersey department of health and senior services: ZINC CHLORATE, abgerufen am 12. Dezember 2015
- William M. Haynes: CRC Handbook of Chemistry and Physics, 96th Edition. CRC Press, 2015, ISBN 978-1-4822-6097-7, S. 99 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu Zinkchlorat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2016. (JavaScript erforderlich)
- Jane E. Macintyre: Dictionary of Inorganic Compounds. CRC Press, 1992, ISBN 978-0-412-30120-9, S. 2897 (eingeschränkte Vorschau in der Google-Buchsuche).
- Heinrich Remy, Heinz Mathies: Zustandsdiagramm des Systems Zn(ClO3)2-H2O. In: Zeitschrift für anorganische und allgemeine Chemie. 329, 1964, S. 203, doi:10.1002/zaac.19643290123.


