Weißfleckensyndrom-Virus
Das Weißfleckensyndrom-Virus (wissenschaftlich White spot syndrome virus, WSSV, auch Chinese baculovirus-like virus, CBV)[3] ist das einzige vom International Committee on Taxonomy of Viruses (ICTV) bestätigte Spezies (und Typusspezies) der Gattung Whispovirus[4] (white spot virus), der einzigen Gattung in der Familie Nimaviridae. Es ist für die Entstehung des Weißfleckensyndroms (englisch White spot syndrome, WSS) bei einer Vielzahl von Krebstieren, speziell Penaeidae (Dendrobranchiata, Zehnfußkrebse), verantwortlich.[5][6] Die Krankheit ist ansteckend und meist tödlich, und sie tötet die Garnelen schnell. Ausbrüche dieser Krankheit haben die gesamte Population vieler Garnelenfarmen auf der ganzen Welt innerhalb weniger Tage ausgelöscht.[7][8]
| Weißfleckensyndrom-Virus | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
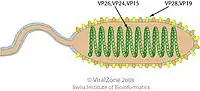
Aufbau eines Virions der Nimaviridae | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Taxonomische Merkmale | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| White spot syndrome virus | ||||||||||||
| Kurzbezeichnung | ||||||||||||
| WSSV | ||||||||||||
| Links | ||||||||||||
|
WSSV wurde früher zur Familie Baculoviridae bzw. direkt in die Gattung Baculovirus gestellt, ist aber inzwischen vom ICTV als eigenständige Familie abgetrennt. Als Erreger des Weißfleckensyndroms WSS können außer WSSV eine Reihe anderer mit ihm verwandter Viren auftreten. Sie bilden eine Gruppe, die auch als Weißflecken-Baculovirus-Komplex (englisch Whitespot Syndrome Baculovirus complex (WSBV)) bezeichnet wird.[3]
Ausbreitungsgeschichte
Die erste gemeldete Epidemie aufgrund dieses Virus stammt aus dem Jahr 1992 von Taiwan.[9] Im darauf folgenden Jahr 1993 kamen Berichte über Verluste aufgrund von Weißfleckensyndrom aus China (Festland), wo es praktisch zu einem Zusammenbruch der Garnelenzucht kam.[10] Im gleichen Jahr folgten Ausbrüche in Japan und Korea, 1994 in Thailand, Indien und Malaysia. 1996 waren ganz Ost- und Südasien schwer betroffen. Ende 1995 wurde gab es Berichte aus den Vereinigten Staaten, 1998 aus Mittel- und Südamerika, 1999 aus Mexiko und 2000 aus den Philippinen, sowie 2011 Aus Saudi-Arabien. Schließlich wurde das Virus im November 2016 in Queensland, Australien, entdeckt. Es wird angenommen, dass Australien die letzte Region war, in der Garnelen noch frei von dem Virus wachsen konnten.[11]
Aufbau
Die Virionen (Viruspartikel) von WSSV sind stäbchenförmig bis ovoid (eiförmig) bei einem Durchmesser von 70–195 nm und einer Länge von 240–380 nm. Der Nukleokapsidkern hat einen Durchmesser von 95–165 nm bei einer Länge von 120–205 nm. Die Virionen haben eine äußere Membranhülle aus einer Lipiddoppelschicht, manchmal mit einem schwanzartigen Anhang an einem Ende des Virions. Das Nucleocapsid besteht aus 15 vertikalen Helices, die sich entlang der Längsachse befinden. Jede Helix weist zwei parallele Streifen auf, die aus 14 globulären Kapsomeren bestehen, von denen jedes einen Durchmesser von 8 nm hat.[12]
Genom
WSSV ist ein doppelsträngiges DNA-Virus (dsDNA-Virus), und damit Mitglied der Gruppe I der Baltimore-Klassifikation. Das Genom ist unsegmentiert (monopartit) und zirkulär (ringförmig) bei einer Länge von 292.967 bp.[12][13] Es kodiert mutmaßlich 531 offene Leserahmen (englisch open reading frames, ORFs). Eines der kodierten Proteine, WSSV449, hat eine gewisse Ähnlichkeit mit dem Wirtsprotein Tube und kann durch Aktivierung des NF-κB-Signalwegs wie Tube funktionieren.[14]
Systematik
Innere Systematik der Familie
Mit Stand März 2019 gibt es in der Familie Nimaviridae nur eine vom International Committee on Taxonomy of Viruses (ICTV) bestätigte Gattung, nämlich Whispovirus, und in dieser nur eine bestätigte Spezies, das White spot syndrome virus (WSSV).[6] Das National Center for Biotechnology Information (NCBI) listet folgende ICTV-bestätigte und putativen Untergruppen und Mitglieder der Familie:[15]
- Familie: Nimaviridae[16]
- Genus: Whispovirus
- Spezies: White spot syndrome virus (WSSV, veraltet: White spot syndrome baculovirus)
- Penaeus monodon nonoccluded baculovirus III
- Shrimp white spot syndrome virus, dazu Isolat Tongan
- nicht klassifizierte Mitglieder der Familie Whispovirus:
- ‚Metopaulias depressus WSSV-like virus‘
- ,Procambarus clarkii virus‘
- nicht klassifizierte Mitglieder der Familie Nimaviridae:
- ‚Hemigrapsus takanoi nimavirus‘
- ‚Marsupenaeus japonicus endogenous nimavirus‘
- ‚Metapenaeus ensis nimavirus‘
- ‚Penaeus monodon endogenous nimavirus‘
- ‚Sesarmops intermedium nimavirus‘
In der Literatur wurden mindestens drei Viren als Erreger des Weißfleckensyndroms (englisch White-Spot-Syndrom, WSS) und somit als Mitglieder des Weißflecken-Baculovirus-Komplexes (WSBV, auch China-Virus-Komplex genannt) angegeben. Sie scheinen sehr ähnliche Viren zu sein. Im Einzelnen sind das:[3]
- Chinesisches hypodermales hämatopoetisches Nekrose-Baculovirus (hypodermal hematopoietic necrosis baculovirus, HHNBV) — verursacht Shrimp Explosive Epidermic Disease (SEED)
- Japanisches rod-shaped nuclear virus (RV-PJ) — befällt Peneus japonicus
- Thailändisches systemisches ektodermales und mesodermales Baculovirus (systemic ectodermal and mesodermal baculovirus, SEMBV), verursacht das red diease und Weißfleckensyndrom bei Penaeus monodon
Wegen der Ausgliederung der Nimavridae aus den Baculoviridae besteht dieser Komplex vermutlich aus Mitgliedern bzw. Kandidaten der Nimaviridae.
Äußere Systematik der Familie
Die Nimaviridae bilden offenbar mit den Baculoviridae, Hytrosaviridae, Nudiviridae und der Gattung Bracovirus der vermutet polyphyletischen Polydnaviridae[17] eine noch unbenannte Verwandtschaftsgruppe, für die von Koonin et al. (2015 und 2019) folgender Stammbaum vorgeschlagen wurde:[18][19]
| ||||||||||||||||||||||
Offenbar liegen die Mitglieder des Weißflecken-Baculovirus-Komplexes alle innerhalb dieser Verwandtschaftsgruppe. Der vom Schweizer Institut für Bioinformatik (SIB) im engen Sinn gebrauchte Begriff “Baculo-like viruses” (nur Baculoviridae und Nudiviridae umfassend)[20] scheint daher von manchen Autoren in einem weiteren Sinn für diese gesamte Gruppe verwendet zu werden. Im 1. Halbjahr 2021 hat das ICTV diese Gruppe als Klasse Naldaviricetes offiziell anerkannt.[1]
Vermehrungszyklus
Die Replikation der Virusteilchen geschieht im Zellkern (nuklear). Die Transkription benutzt die Virus-DNA als Vorlage.[5]
Das Virus infiziert eine ungewöhnlich große Anzahl von Krebstieren.[5] Die Übertragung des Virus erfolgt hauptsächlich durch orale Aufnahme über das Wasser (horizontale Übertragung) und von infizierten Muttergarnelen (vertikale Übertragung) in Shrimps-Farmen und Krabbenbrutbetrieben.[21] Das Virus kommt auch in wilden Garnelembeständen vor, insbesondere in den Küstengewässern, die an Garnelenzuchtanlagen in asiatischen Ländern angrenzen. Bei den wilden Garnelen wurden jedoch keine Massensterblichen beobachtet.
Pathologie
Im Wirt befällt WSSV eine Vielzahl von Zellen ektodermaler und mesodermaler Herkunft. Histologische Veränderungen sind im Kiemenepithel, in der Antennendrüse, im hämatopoetischen Gewebe (englisch Hematopoietic tissue), im Nervengewebe, im Bindegewebe und im Darmepithelgewebe zu beobachten. Infizierte Zellen weisen auffällige intranukleäre Okklusionen auf, sind anfänglich eosinophil, aber mit zunehmendem Alter basophil anfärbbar. Sie haben hypertrophierte Kerne mit Chromatinrand und zytoplasmatisches Clearing. Die Pathogenese (Krankheitsverlauf) beinhaltet eine sich ausbreitende Gewebenekrose und -zerfall.[22]
Weiße Flecken auf der Schale infizierter Garnelen erscheinen unter dem Rasterelektronenmikroskop als große, kuppelförmige Flecken auf dem Panzer mit einem Durchmesser von 0,3 bis 3,0 mm. Kleinere weiße Flecken von 0,02 bis 0,10 mm erscheinen als verbundene Kugeln auf der Oberfläche der Cuticula. Die chemische Zusammensetzung der Flecken ähnelt der des Panzers, wobei das Kalzium 80–90 % des gesamten Materials ausmacht und möglicherweise auf Anomalien der Cuticulaepidermis zurückzuführen ist.[23]
Nach der Infektion mit diesem Virus lassen sich mehrere biochemische Veränderungen beobachten: Der Glukoseverbrauch und die Lactat-Konzentration im Zytoplasma steigen, die Aktivität der Glukose-6-Phosphat-Dehydrogenase steigt und die Triglycerid-Konzentration sinkt. Der potentialabhängige Anionenkanal der Mitochondrien ist ebenfalls hochreguliert.[24]
Diagnose
Die Infektion mit WSSV unterscheidet sich in den beschriebenen histologischen Befunden von anderen beschriebenen Penaeid-Infektionen, beispielsweise durch das Yellowhead-Virus (YHV) und dem Decapod penstyldensovirus 1[25] (alias Infectious hypodermal and hematopoietic necrosis virus, IHHNV),[26] da YHV eine verringerte Gewebespezifität aufweist und nur die intestinalen Epithelgewebe infiziert, und IHHNV intranukleäre Okklusionen verursacht, die eosinophil anfärbbar sind, was sich aber im Verlauf der Infektion bei diesem Virus nicht verändert.[22]
Eine schnelle und spezifische Diagnose des Virus kann durch nested-PCR oder quantitative PCR erfolgen.[27]
Therapie
Es sind keine Behandlungen für WSS bekannt.
Vorbeugung
Eine große Anzahl von Desinfektionsmitteln wird häufig in Garnelenfarmen und Aufzuchtstationen eingesetzt, um einen Ausbruch von WSS zu verhindern. Die Lagerung nicht infizierter Garnelensamen und das sorgfältige Fernhalten von Umweltbelastungen zur Vermeidung von Kontaminationen sind nützliche Bewirtschaftungsmaßnahmen. Die Standortauswahl ist möglicherweise einer der wichtigsten Faktoren zur Verhinderung von WSS. Garnelen, die in Gebieten mit relativ geringen Temperaturschwankungen und bei Wassertemperaturen von mehr als 29 °C gezüchtet wurden, wiesen eine erhöhte WSSV-Resistenz auf.[28]
Weblinks
- Nimaviridae. ICTV – mit Liste der verschiedenen Isolate von WSSV
- Tierkrankheiten – Aquakultur/Fisch ThermoFisher
- Lisa Sperling: Prävalenz und Chrarkterisierung der Antibiotikaresistenz von Vibtio spp. in Shrimps aus dem Einzelhandel und Aquakulturen Ecuadors. (PDF; 8,5 MB) Institut für Lebensmittelsicherheit und -hygiene, FU Berlin (Dissertation)
Einzelnachweise
- ICTV: ICTV Master Species List 2020.v1, New MSL including all taxa updates since the 2019 release, March 2021 (MSL #36)
- SIB: Double Strand DNA Viruses, auf: ViralZone.
- Whitespot Syndrome Baculovirus complex (WSBV). Gulf States Marine Fisheries Commission. 2003. Archiviert vom Original am 18. Oktober 2005. Abgerufen am 30. Juni 2005.
- Roxane-Marie Barthélémy, Eric Faure, Taichiro Goto: Serendipitous Discovery in a Marine Invertebrate (Phylum Chaetognatha) of the Longest Giant Viruses Reported till Date. In: Biology, 2019, Abstract, hilarispublisher.com (PDF; 1,3 MB)
- Viral Zone. ExPASy. Abgerufen am 5. September 2019.
- ICTV: ICTV Master Species List 2018b.v2 MSL #34v, März 2019
- Donald V. Lightner: A handbook of shrimp pathology and diagnostic procedures for diseases of cultured penaeid shrimp. World Aquaculture Society, Baton Rouge, Louisiana, USA, 1996.
- W.-B. Zhan, Y.-H. Wang, J. L. Fryer, K.-K. Yu, H. Fukuda, Q.-M. Meng: White spot syndrome virus infection of cultured shrimp in China. In: J. Aquat. Anim. Health, Band 10, 1998, S. 405–410, Cefas Abstract
- S. N. Chen: Current status of shrimp aquaculture in Taiwan.. In: C. L. Browdy, J. S. Hopkins (Hrsg.): Swimming through troubled water. Proceedings of the special session on shrimp farming. Aquaculture ’95. World Aquaculture Society, Baton Rouge, Louisiana, USA, 1995, S. 29–34.
- J. Huang, J., X. L. Song, J. Yu, C. H. Yang et al.: Baculoviral hypodermal and hematopoietic necrosis: study on the pathogen and pathology of the explosive epidemic disease of shrimp. In: Marine Fisheries Research. 16, 1995, S. 1–10.
- White Spot Detected on Queensland Prawn Farm. In: The Fish Site. 2. Dezember 2016. Abgerufen am 8. Dezember 2016.
- E. C. B. Nadala Jr., L. M. Tapay, P. C. Loh et al.: Characterization of a non-occluded baculovirus-like agent pathogenic to penaeid shrimp. In: Diseases of Aquatic Organisms. 33, Nr. 3, 1998, S. 221–229. doi:10.3354/dao033221. PMID 9745719.
- M. C. W. Van Hulten, J. Witteveldt, S. Peters, N. Kloosterboer, R. Tarchini, F. Fiers, H. Sandbrink, R. K. Lankhorst, J. M. Vlak et al.: The white spot syndrome virus DNA genome sequence. In: Virology. 286, Nr. 1, 2001, S. 7–22. doi:10.1006/viro.2001.1002. PMID 11448154.
- PH Wang, ZH Gu, DH Wan, MY Zhang, SP Weng, XQ Yu, JG He: The shrimp NF-κB pathway is activated by white spot syndrome virus (WSSV) 449 to facilitate the expression of WSSV069 (ie1), WSSV303 and WSSV371. In: PLoS ONE. 6, Nr. 9, 2011, S. e24773. doi:10.1371/journal.pone.0024773. PMID 21931849. PMC 3171479 (freier Volltext).
- NCBI: Nimaviridae
- SiB: Nimaviridae, auf: ViralZone
- C Dupuy, E Huguet, JM Drezen: Unfolding the evolutionary story of polydnaviruses. In: Virus Res. 117, Nr. 1, 2006, S. 81–89. doi:10.1016/j.virusres.2006.01.001. PMID 16460826.
- Eugene V. Koonin, Natalya Yutin: Evolution of the Large Nucleocytoplasmatic DNA Viruses of Eukaryotes and Convergent Origins of Viral Gigantism. In: Advances in Virus research, Band 103, AP 21. Januar 2019, doi:10.1016/bs.aivir.2018.09.002, S. 167–202
- Eugene V. Koonin, Valerian V. Dolja, Mart Krupovic: Origins and evolution of viruses of eukaryotes: The ultimate modularity. In: Virology, Mai 2015, S. 479–480. 2–25, Epub 12. März 2015, PMC 5898234 (freier Volltext), PMID 25771806
- SIB: Double Strand DNA Viruses, auf: ViralZone
- Michael Wolfinger: Krankheiten bei Flusskrebse - Aquakultur, Weißfleckenkrankheit (WSSV - White Spot Syndrom Virus)
- C. Wongteerasupaya, J. E. Vickers, S. Sriurairatana, G. L. Nash, A. Akarajamorn, V. Boonseang, S. Panyin, A. Tassanakajon, B. Withyachumnarnkul, T. W. Flegel et al.: A non-occluded, systemic baculovirus that occurs in cells of ectodermal and mesodermal origin and causes high mortality in the black tiger prawn Penaeus monodon. In: Diseases of Aquatic Organisms. 21, 1995, S. 69–77. doi:10.3354/dao021069.
- C. S. Wang, K. F. Tang, G. H. Kou, S. N. Chen et al.: Light and electron microscopic evidence of white spot disease in the giant tiger shrimp, Penaeus monodon (Fabricius), and the kuruma shrimp, Penaeus japonicus (Bate), cultured in Taiwan. In: Journal of fish Diseases. 20, Nr. 5, 1997, S. 323–331. doi:10.1046/j.1365-2761.1997.00301.x.
- IT Chen, T Aoki, YT Huang, I Hirono, TC Chen, JY Huang, GD Chang, CF Lo, KC Wang: White spot syndrome virus induces metabolic changes resembling the Warburg effect in shrimp hemocytes in the early stage of infection. In: J Virol, 2011
- ICTV: Decapod penstyldensovirus 1 Taxonomy history
- NCBI: Decapod penstyldensovirus 1 syn. Infectious hypodermal and h[a]ematopoietic necrosis virus, acronym IHHNV
- A. K Dhar, M. M. Roux, K. R. Klimpel et al.: Detection and Quantification of Infectious Hypodermal and Hematopoietic Necrosis Virus and White Spot Virus in Shrimp Using Real-Time Quantitative PCR and SYBR Green Chemistry. In: Journal of Clinical Microbiology. 39, Nr. 8, 2001, S. 2835–2845. doi:10.1128/JCM.39.8.2835-2845.2001. PMID 11474000. PMC 88247 (freier Volltext).
- S. Kakoolaki, I. Sharifpour, M. Afsharnasab, A. Sepahdari, M.R. Mehrabi, B. Ghaednia, H.b Nezamabadi: Effects of temperature on hematological and histopathological changes and survival rate of juvenile Fenneropenaeus vannamei experimentally challenged to White Spot Virus. In: Iranian Journal of Fisheries Sciences. 13, Nr. 1, 2014, S. 91–102.