Uran(V,VI)-oxid
Uran(V,VI)-oxid (auch Triuranoctoxid, U3O8) ist eine chemische Verbindung des Urans und zählt zu den Oxiden. Es kommt in mehreren Modifikationen vor. Pechblende enthält kein Uran(V,VI)-oxid, sondern Uran(IV)-oxid und zusätzlichen Sauerstoff.[6]
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
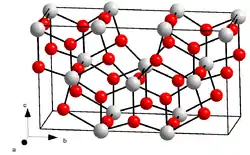 | ||||||||||||||||
| _ U5+/6+ _ O2− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Uran(V,VI)-oxid | |||||||||||||||
| Andere Namen |
Triuranoctoxid | |||||||||||||||
| Verhältnisformel | U3O8 | |||||||||||||||
| Kurzbeschreibung |
grünschwarze orthorhombische Kristalle[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 842,08 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
8,38 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[2] | |||||||||||||||
| Gefahren- und Sicherheitshinweise | ||||||||||||||||

Radioaktiv | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Darstellung
Uran(V,VI)-oxid entsteht beim Erhitzen von Uran(VI)-oxid auf 700–900 °C durch Sauerstoffabgabe bzw. aus Uran(IV)-oxid durch Sauerstoffaufnahme.[7] Genauso bildet es sich beim Erhitzen von anderen Uranoxiden auf ähnliche Temperaturen an der Luft.[8]
Eigenschaften
Physikalische Eigenschaften
Uran(V,VI)-oxid bildet mehrere Modifikationen. In reinem Uran(V,VI)-oxid ist bei Zimmertemperatur die orthorhombische α-Struktur mit der Raumgruppe C2mm (Nr. 38, Stellung 4) und den Gitterparametern a = 671 pm, b = 1196 pm und c = 414 pm thermodynamisch stabil. Sie geht oberhalb von 210 °C reversibel in eine hexagonale Form (a = 681 pm, c = 414 pm, Raumgruppe P62m (Nr. 189)) über.[9] Bei Zimmertemperatur metastabil ist die orthorhombische β-Struktur mit der Raumgruppe Cmcm (Nr. 63) und den Gitterparametern a = 707 pm, b = 1145 pm und c = 830 pm, die durch Erhitzen von α-U3O8 auf 1350 °C an der Luft und langsames Abkühlen gebildet werden kann.[10] Daneben ist auch eine kubische, nur bei hohem Druck stabile, unterstöchiometrische Modifikation bekannt.[2]
Uran(V,VI)-oxid ist abhängig vom Sauerstoffgehalt leitfähig, bei Raumtemperatur beträgt die Elektrische Leitfähigkeit bei genau stöchiometrischem Uran(V,VI)-oxid etwa 100 Ω−1·m−1. Die Verbindung ist ein Halbleiter vom n-Typ.[2]
Frisch erzeugtes Uran(V,VI)-oxid aus irdischem Natururan hat eine spezifische Aktivität von 21450 Bq/g.
Chemische Eigenschaften
Triuranoctoxid löst sich leicht in oxidierenden Säuren unter Bildung von Uranylionen. Bei der Reaktion mit Chlorwasserstoff bei 700 °C entsteht Uranylchlorid.[2]
Durch Reaktion mit Wasserstoff bei 700 °C oder Kohlenstoffmonoxid bei 350 °C wird es über mehrere unstöchiometrische Zwischenprodukte zu Uran(IV)-oxid reduziert.[8]
Verwendung
Da Uran(V,VI)-oxid bei gleichen Temperaturen aus allen Uranoxiden entsteht, wird es zur gravimetrischen Bestimmung des Urangehaltes, etwa von Erzen, genutzt.[8]
Literatur
- Ingmar Grenthe, Janusz Drożdżynński, Takeo Fujino, Edgar C. Buck, Thomas E. Albrecht-Schmitt, Stephen F. Wolf: Uranium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements. Springer, Dordrecht 2006, ISBN 1-4020-3555-1, S. 253–698 (doi:10.1007/1-4020-3598-5_5).
Einzelnachweise
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Properties of the Elements and Inorganic Compounds, S. 4-97.
- Martin Peehs, Thomas Walter, Sabine Walter, Martin Zemek: Uranium, Uranium Alloys, and Uranium Compounds. In: Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, 2007 (doi:10.1002/14356007.a27_281.pub2).
- Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag uranium compounds with the exception of those specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Uranverbindungen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung.
- Eintrag zu Uranpecherz. In: Römpp Online. Georg Thieme Verlag, abgerufen am 27. August 2012.
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1227.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1971.
- B. O. Loopstra: The Phase Transition in α-U3O8 at 210ºC. In: Journal of Applied Crystallography, 1970, 3, S. 94–96 (doi:10.1107/S002188987000571X).
- B. O. Loopstra: The structure of β-U3O8. In: Acta Crystallographica B, 1970, 26, S. 656–657 (doi:10.1107/S0567740870002935).


