Tschugajew-Reaktion
Die Tschugajew-Reaktion (auch Chugaev-Reaktion oder Chugaev-Eliminierung) ist eine Namensreaktion aus dem Bereich der Organischen Chemie. Die Reaktion wurde 1899 von dem russischen Chemiker Lew Alexandrowitsch Tschugajew (1873–1922) entdeckt, als er eine mildere Alternative zur Dehydratisierung mittels Esterpyrolyse suchte.

Bei der Tschugajew-Reaktion oder -Eliminierung werden primäre, sekundäre oder auch tertiäre Alkohole durch Dehydratisierung in die entsprechenden terminalen Alkene überführt. Als Zwischenprodukte treten Xanthogenate auf, die durch Thermolyse in die entsprechenden Olefine zerfallen. Formal kann die Tschugajew-Reaktion als eine Art der Esterpyrolyse angesehen werden, die jedoch aufgrund der geringen Stabilität von Xanthogenaten bereits bei Temperaturen von 100–200 °C abläuft. Somit können etwaige Neben- oder Umlagerungsreaktionen größtenteils vermieden werden.[1]
Übersichtsreaktion
Primäre, sekundäre oder tertiäre Alkohole werden zunächst mit einer Base, Kohlenstoffdisulfid und Methyliodid zu einem Xanthogenat-Ester umgesetzt, welcher dann thermisch unter Abspaltung von Carbonylsulfid und Methanthiol zum entsprechenden terminalen Alken umgeladert wird.
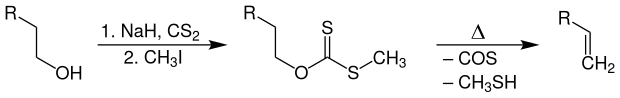
Reaktionsmechanismus
Im ersten Reaktionsschritt wird der Alkohol (1), welcher in β-Stellung zum Sauerstoff-Atom ein Wasserstoff-Atom besitzen muss, von einer Base (z. B. NaH, NaOH, KOH etc.) zu einem Alkoholat (2) umgesetzt. Dieses addiert sich in einem nucleophilen Angriff an den elektrophilen Kohlenstoff im Kohlenstoffdisulfid (3), wobei ein Xanthogenat-Salz (4) entsteht, welches – meist mit Methyliodid – zu einem Xanthogenat-Ester (5) alkyliert (methyliert) wird. Erhitzt man diesen auf Temperaturen von 100–200 °C, tritt eine stereospezifische syn-Eliminierung (Ei-Reaktion), die über einen sechsgliedrigen Übergangszustand (6) verläuft, ein. Dabei wird ein Wasserstoffatom vom β-C-Atom auf den Schwefel des Xanthogenat-Esters übertragen, wobei die C-O-Bindung fragmentiert und sich das terminale Alken (7) bildet. Das Nebenprodukt – ein Dithiokohlensäureester (8) – zerfällt weiter zu Methanthiol (9) und Carbonylsulfid (10).[2]

Die Pyrolyse von Xanthogenaten primärer Alkohole liefert nur ein Alken. Bei sekundären Alkoholen können auch Regioisomere auftreten.[3]
Pyrolyse anderer Ester und analoger Substanzen
Eine ähnliche Reaktion gehen auch andere Ester, wie z. B. Urethane, Kohlensäure- und Essigsäureester oder Aminoxide (Cope-Eliminierung) ein. Die Tendenz der Pyrolyse nimmt wie folgt ab:

Aminoxide lassen sich bei 80 bis 160 °C, Xanthogensäureester bei 120 bis 200 °C und Carbonsäureester erst bei 400 bis 500 °C pyrolysieren.
Literatur
- Reinhard Brückner: Reaktionsmechanismen – Organische Reaktionen, Stereochemie, Moderne Synthesemethoden. 3. Auflage. Springer Spektrum, Berlin-Heidelberg 2015, ISBN 978-3-662-45683-5, S. 169 f.
- Hans P. Latscha: Chemie-Basiswissen. Springer, Berlin 2002.
- Organikum. VEB Deutscher Verlag der Wissenschaften, Berlin 1976.
Einzelnachweise
- L. Tschugaeff: Ueber eine neue Methode zur Darstellung ungesättigter Kohlenwasserstoffe. In: Berichte der deutschen chemischen Gesellschaft. 32, Nr. 3, 1899, S. 3332–3335, doi:10.1002/cber.18990320398 (PDF).
- Organikum. 23. Auflage, Wiley-VCH, 2009, ISBN 978-3-527-32292-3, S. 286.
- Thomas Laue, Andreas Plagens: Namen- und Schlagwort-Reaktionen der Organischen Chemie. 5. Auflage. Vieweg+Teubner Verlag, Wiesbaden 1998, ISBN 978-3-519-23526-2, S. 59–62.