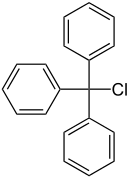
Tritylchlorid
Tritylchlorid ist eine reaktionsfreudige organisch-chemische Substanz, die als Schutzgruppe für primäre Alkohole eingesetzt wird.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Tritylchlorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C19H15Cl | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 278,78 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
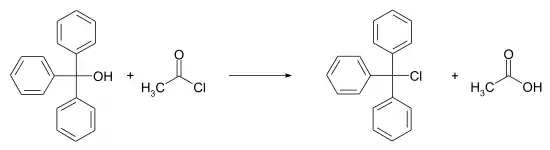
Herstellung
Tritylchlorid ist kommerziell erhältlich. Zur Herstellung setzt man Triphenylmethanol mit Acetylchlorid um. Alternativ liefert die Friedel-Crafts-Alkylierung von Benzol mit Tetrachlorkohlenstoff ein Salz aus Tritylchlorid und Aluminiumchlorid, das bei der Hydrolyse Tritylchlorid liefert.[3]
Eigenschaften
Die wichtigsten thermodynamischen Eigenschaften sind in der folgenden Tabelle aufgelistet:
| Eigenschaft | Formelzeichen | Wert (Bemerkung) |
|---|---|---|
| Standardbildungsenthalpie | ΔfH0(s) | 183 kJ·mol−1[4] |
| Verbrennungsenthalpie | ΔcH0(s) | −9826 kJ·mol−1[4] |
| Wärmekapazität | cp | 367,27 J·mol−1·K−1 (als Feststoff bei 25 °C)[5] |
| Schmelzenthalpie | ΔfH0 | 27,9 kJ·mol−1 (am Schmelzpunkt)[5] |
| Schmelzentropie | ΔfS0 | 74,1 kJ·mol−1 (am Schmelzpunkt)[5] |
Verwendung
Zur Synthese von Tritylethern setzt man einen Alkohol mit Tritylchlorid (Ph3CCl, abgekürzt TrCl) in Gegenwart einer Base (z. B. Pyridin) um.[6] Aus sterischen Gründen werden ausschließlich primäre Alkohole mit Tritylchlorid verethert und es ist beispielsweise bei Monosacchariden möglich, die Hydroxygruppe an C-6 selektiv neben allen anderen zu schützen.[7][8]
Außerdem kann das Triphenylmethylradikal aus Tritylchlorid hergestellt werden.[9]
Einzelnachweise
- Datenblatt Trityl chloride, purum bei Sigma-Aldrich, abgerufen am 19. Mai 2017 (PDF).
- Eintrag zu Chlortriphenylmethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- W. E. Bachmann, C. R. Hauser, Boyd E. Hudson, Jr.: Triphenylchloromethane In: Organic Syntheses. 23, 1943, S. 100, doi:10.15227/orgsyn.023.0100; Coll. Vol. 3, 1955, S. 841 (PDF).
- Schmidlin, M.J.: Recherches chimiques et thermochimiques sur la constitution des rosanilines in Ann. Chim. Phys., 1906, 1, 195–256.
- Naoki, M.; Seki, M.; Kugo, H.; Saito, F.; Taioka, T.: Dielectric relaxation in supercooled triphenylchloromethane and intrinsic factor determining mobility in molecular liquids in J. Phys. Chem. 95 (1991) 5628–5633.
- Jonathan Clayden, Nick Greeves, Stuart Warren, Peter Wothers: Organic Chemistry. Oxford University Press, 2001, S. 1370. ISBN 978-0-19-850346-0.
- P. Collins, R. Ferrier: Monosacharides - Their Chemistry and their Roles in Natural Products. Wiley West Sussex 1995, ISBN 0-471-95343-1.
- P. J. Kocieński: Protecting Groups. Georg Thieme Verlag, Stuttgart 1994, ISBN 3-13-135601-4.
- Jerry March, 1929–1997.: Advanced organic chemistry : reactions, mechanisms, and structure. 3rd ed Auflage. Wiley, New York 1985, ISBN 0-471-88841-9.

