Trifluormethylschwefelpentafluorid
Trifluormethylschwefelpentafluorid ist eine chemische Verbindung aus der Gruppe der Fluoride, welche ein sehr hohes Treibhauspotential hat.[4] Es wurde in im Jahr 2000 in der Erdatmosphäre nachgewiesen. Messungen in antarktischen Firnschneeschichten zeigen, dass es seine Konzentration von nahezu Null in den späten 1960er Jahren auf etwa 0,12 Teile pro Billion im Jahr 1999 angewachsen ist.[5] Die Lebensdauer in der Atmosphäre wird auf 1000 Jahre geschätzt.[6]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
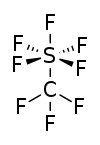 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Trifluormethylschwefelpentafluorid | ||||||||||||||||||
| Summenformel | CF8S | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit bei −20,4 °C[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 196,06 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
−20,4 °C[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Treibhauspotential |
17700[3] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Trifluormethylschwefelpentafluorid kann durch Reaktion von Methylmercaptan mit Cobalt(III)-fluorid bei 250 °C oder durch Reaktion von Methylmercaptan mit einem Überschusses an mit Stickstoff verdünntem Fluor in Gegenwart von mit Silberfluorid beschichteten Kupferspänen bei 200 °C gewonnen werden. Eine präparative Methode, die die höchste Ausbeute an Trifluormethylschwefelpentafluorid ergab, ist die Reaktion von Schwefelkohlenstoff mit Cobalt(III)-fluorid bei etwa 250 °C.[1] Es kann auch durch Fluorierung von Methanol[1] oder durch Reaktion von Bis(trifluormethyl)disulfid mit Cobalt(III)-fluorid gewonnen werden.[7] Auch die Darstellung durch Reaktion von Kohlenstoffdisulfid mit Cobalt(III)-fluorid oder Fluor ist möglich, wobei neben Trifluormethylschwefelpentafluorid noch mehrere andere Derivate entstehen.[8] Wissenschaftler vermuten, dass das die Verbindung auch bei Entladungen und Schaltvorgängen in Hochspannungsanlagen entsteht, die Schwefelhexafluorid verwenden, um Funkenbildung in elektrischen Schaltanlagen zu unterdrücken.[9]
Eigenschaften
Trifluormethylschwefelpentafluorid ist ein Gas, das nur bei Rotglut schnell mit Alkalimetallen reagiert. Es wurden keine Hinweise auf die Reaktion der Verbindung mit Natriumhydroxid bei Raumtemperatur gefunden. Trifluormethylschwefelpentafluorid ist bei niedrigem Druck ein sehr guter Isolator, zersetzt sich aber durch Funkenüberschlag zu Kohlenstofftetrafluorid und Schwefeltetrafluorid. Trifluormethylschwefelpentafluorid siedet bei −20,4 °C, schmilzt bei −86,9 ± 0,2 °C und hat eine Übergangsstelle bei −153,3 ± 0,3 °C.[1] Es besitzt ein sehr hohes Absorptionsvermögen für Wärmestrahlung.[9]
Literatur
- Kiryl Batvinyeu: Entwicklung einer neuen Methode zur Messung von SF5CF3, Institut für Umweltphysik Ruprecht-Karls-Universität Heidelberg, 2012
Einzelnachweise
- Gene A. Silvey, George H. Cady: Trifluoromethylsulfur Pentafluoride. In: Journal of the American Chemical Society. 72, 1950, S. 3624, doi:10.1021/ja01164a084.
- SynQuest Labs, Inc.: Trifluoromethylsulfur pentafluoride | SynQuest Labs, Inc., abgerufen am 1. November 2018
- Code of Federal Regulations: Code of Federal Regulations, abgerufen am 1. November 2018
- Eizi Hirota, Yoshiyuki Kawasima, Ken Ajiki: Internal rotation in trifluoromethylsulfur pentafluoride: CF3SF5 by Fourier transform microwave spectroscopy. In: Journal of Molecular Spectroscopy. 342, 2017, S. 100, doi:10.1016/j.jms.2017.06.015.
- W. T. Sturges: A Potent Greenhouse Gas Identified in the Atmosphere: SF5CF3. In: Science. 289, S. 611, doi:10.1126/science.289.5479.611.
- Martin Suen: Trifluoromethyl Sulfur Pentafluoride (CF3SF5): A Review of the Recently Discovered Super-Greenhouse Gas in the Atmosphere. In: The Open Atmospheric Science Journal. 2, 2008, S. 56, doi:10.2174/1874282300802010056.
- US EPA: Document Display | NEPIS | US EPA, abgerufen am 1. November 2018.
- Norman Kharasch, Cal Y. Meyers: The Chemistry of Organic Sulfur Compounds. Elsevier, 2013, ISBN 978-1-4831-5611-8, S. 178 (eingeschränkte Vorschau in der Google-Buchsuche).
- innovations-report.de: Neues Treibhausgas industriellen Ursprungs in der Atmosphäre gefunden, abgerufen am 1. November 2018

