Lactoperoxidase
Das Enzym Lactoperoxidase (LPO) kommt in den meisten Tieren vor und wird im Menschen von den Brustdrüsen, Speicheldrüsen und Schleimdrüsen der Bronchien ausgeschieden. Es katalysiert die Oxidation von Phenolen und verschiedenen Anionen durch Wasserstoffperoxid. Die Reaktionsprodukte sind hochreaktive Moleküle, die toxisch auf in den Körper eingedrungene Mikroorganismen wirken. LPO ist daher ein Teil des angeborenen (unspezifischen) Immunsystems und ermöglicht die Neutralisierung von Bakterien in der Milch und anderen Schleimhautsekreten.[2][3][4][5][6][7][8][9][10][11]
| Lactoperoxidase | ||
|---|---|---|
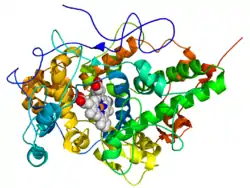
| ||
| Bändermodell der Lactoperoxidase der Hausziege (Capra hircus). Das Protein ist in Regenbogenfarben dargestellt (N-Terminus = blau, C-Terminus = rot) während das Häm mit Kugeln dargestellt ist (Kohlenstoff-Atome = weiß, Sauerstoff-Atome = rot, Stickstoff-Atome = blau, Eisenatom = orange).[1] | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 612 aa | |
| Kofaktor | Ca2+, Häm b | |
| Präkursor | (712 aa) | |
| Bezeichner | ||
| Gen-Name | LPO | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.11.1.7, Oxidoreduktase | |
| Reaktionsart | Redoxreaktion | |
| Substrat | Iodid, Bromid, Thiocyanat + H2O2 | |
| Produkte | Hypoiodit, Hypobromit, Hypothiocyanit + H2O | |
| Vorkommen | ||
| Übergeordnetes Taxon | Tiere | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 4025 | 76113 |
| Ensembl | ENSG00000167419 | ENSMUSG00000009356 |
| UniProt | P22079 | Q5SW46 |
| Refseq (mRNA) | NM_001160102 | NM_080420 |
| Refseq (Protein) | NP_001153574 | NP_536345 |
| Genlocus | Chr 17: 58.24 – 58.27 Mb | Chr 11: 87.81 – 87.83 Mb |
| PubMed-Suche | 4025 | 76113 |
Unter dem Lactoperoxidase-System versteht man die Kombination aus Lactoperoxidase und dessen ionischen Substraten, dem Wasserstoffperoxid sowie den Oxidationsprodukten. Bekannte Substrate sind Bromid- und Iodid-Ionen, aber auch das Thiocyanat-Ion. Die Produkte der enzymkatalysierten Oxidation sind stark antibakteriell wirksam, vermutlich durch Hemmung der Glucose-Aufnahme.[12]
Struktur
Die Struktur der Lactoperoxidase besteht hauptsächlich aus α-Helices. Hinzu kommen zwei kurze antiparallele β-Faltblätter. Ein Häm-Cofaktor befindet sich nahe dem Zentrum des Apoproteins.[1]
Funktion
Die Lactoperoxidase katalysiert die Oxidation verschiedener Sauerstoff-Akzeptoren durch Wasserstoffperoxid (H2O2):[13]
- reduzierter Akzeptor + H2O2 → oxidierter Akzeptor + H2O
Beispiele solcher Oxidationsreaktionen sind:
- Thiocyanat (SCN−) → Hypothiocyanit (OSCN−)[14][15]
- Bromid (Br−) → Hypobromit (BrO−)
- Iodid (I−) → Hypoiodit (IO−)
Quelle des Wasserstoffperoxids ist vielfach die Reaktion von Glucose mit Sauerstoff in Gegenwart des Enzyms Glucose-Oxidase (EC 1.1.3.4), die ebenfalls im Speichel stattfindet. Die Glucose wiederum kann in Gegenwart des Speichel-Enzyms Amyloglucosidase (γ-Amylase (EC 3.2.1.3)) aus Stärke entstehen. Derartige Oxidationsprodukte sind hoch reaktiv und antibakteriell stark wirksam.[16][11] Das Lactoperoxidase-System ist in der Lage, eine ganze Reihe von aerobischen[17] und anaerobischen Bakterien,[18] darunter auch mikroaerophile Helicobacter pylori.[19] Der Effekt des Lactoperoxidase-Systems hängt von bestimmten experimentellen Bedingungen ab. Wenn Bakterien unter aerobischen Bedingungen auf Nähragar kultiviert werden sollen, nachdem sie dem Lactoperoxidase-System ausgesetzt waren, wachsen sie nicht. Allerdings wachsen sie sehr wohl auf Blut-Agar unter anaerobischen Bedingungen.[20] Das Lactoperoxidase-System scheint synergistisch mit Lactoferrin[21] und Lysozym[22] zu agieren. Ist Wasserstoffperoxid im Überschuss zum Thiocyanat vorhanden, kann das Lactoperoxidase-System auch cytotoxisch wirken.[20]
Anwendungen[23]
Aufgrund der antibakteriellen Wirksamkeit des Lactoperoxidase-Systems wird es zur Konservierung von Nahrungsmitteln und Kosmetika sowie in der Augenheilkunde eingesetzt. Weitere Anwendungen finden sich in den Bereichen Zahnheilkunde und Wundbehandlung. Möglicherweise kann das Lactoperoxidase-System auch zur Bekämpfung von Tumoren und Viren eingesetzt werden.[24][25][26][27]
Milch und Milchprodukte
Das Lactoperoxidase-System hemmt das Wachstum der bakteriellen Flora in der Milch und in Milchprodukten.[28] Die Zugabe von Wasserstoffperoxid und einem Thiocyanat verlängert die Haltbarkeit gekühlter Rohmilch.[13][29][30][31] Das Lactoperoxidase-System ist vergleichsweise wärmestabil und wird als Indikator für eine Überpasteurisierung von Milch verwendet.[32]
Zahnheilkunde
Das Lactoperoxidase-System scheint auch zur Behandlung von Karies, Gingivitis und Parodontitis geeignet zu sein[33] und wird daher als Bestandteil von Zahnpasten und Mundspüllösungen eingesetzt. Weil es das Bakterienwachstum in der Mundhöhle hemmt, hemmt es auch die Säureproduktion dieser Bakterien.[34]
Klinische Bedeutung des Lactoperoxidase-Systems
Zahn- und Mundgesundheit
In den letzten Jahrzehnten sind eine Reihe von klinischen Studien zur Wirksamkeit des Lactoperoxidase-Systems in verschiedenen Mundhygiene-Produkten (Zahnpasten, Mundspüllösungen) veröffentlicht worden. Nachdem indirekt über die Messung experimenteller Gingivitis- und Karies-Parameter gezeigt worden war, dass Mundspüllösungen,[35][36] welche Amyloglucosidase (γ-Amylase) und Glucose-Oxidase enthalten, das Lactoperoxidase-System aktivieren, sind aus jüngster Zeit Studien bekannt, die den Mechanismus der Schutzfunktion von Enzymen in Mundhygieneprodukten beleuchten. So werden Enzyme wie Lysozym, Lactoperoxidase und Glucose-Oxidase von den Zahnpasten auf das Pellikel übertragen. Als Bestandteil des Pellikels sind diese Enzyme katalytisch hoch aktiv.[37][38] Ebenso hat das Lactoperoxidase-System als Bestandteil von Zahnpasten einen günstigen Einfluss auf die Vermeidung frühkindlicher Karies,[39] indem es die Zahl gebildeter Kolonien kariogener Mikroflora herabsetzt, während gleichzeitig die Thiocyanat-Konzentration steigt. Zahnpasten mit dem Lactoperoxidase-System erwiesen sich bei Xerostomie-Patienten im Vergleich zu fluoridhaltigen Zahnpasten hinsichtlich Plaque-Bildung und Zahnfleischentzündungen als überlegen.[40] Weitere Studien dieser Art sollten folgen,[41] nicht zuletzt um den Mechanismus der Schutzwirkung näher zu beleuchten, welcher noch nicht genau aufgeklärt ist.[42] Die Anwendung von Lactoperoxidase ist nicht auf Karies, Gingivitis und Parodontitis beschränkt.[43] So kann eine Kombination aus Lysozym und Lactoperoxidase auch zur unterstützenden Behandlung des Burning Mouth Syndroms (Glossodynie) eingesetzt werden. In Kombination mit Lactoferrin wirkt Lactoperoxidase gegen Mundgeruch,[44] in Kombination mit Lactoferrin und Lysozym trägt Lactoperoxidase zur Linderung von Beschwerden wegen Mundtrockenheit (Xerostomie) bei.[45] Ebenso können Gele mit Lactoperoxidase bei Mundhöhlenkrebs-Patienten, deren Speichelfluss infolge von Bestrahlungen eingeschränkt ist (Xerostomie), zur Symptomlinderung beitragen und gleichzeitig die Bakterienflora günstig beeinflussen.[46][47][48]
Zystische Fibrose
Im Speichel von Patienten mit zystischer Fibrose wird weniger Thiocyanat gefunden als in gesunden Patienten.[49] Weil so auch weniger antibakteriell wirksames Hypothiocyanit gebildet werden kann, könnte dies ein Grund dafür sein, dass diese Patienten gehäuft unter Atemwegserkrankungen leiden.[50][51]
Krebs
Antikörper-Konjugate mit Lactoperoxidase töten Tumorzellen ab.[24] Makrophagen, die Lactoperoxidase ausgesetzt waren, können Tumorzellen verstärkt neutralisieren.[25] Die Oxidation von Estradiol durch Lactoperoxidase wird als mögliche Quelle für oxidativen Stress bei Brustkrebs gehandelt.[52][53][53] Auch Östrogen wird in Gegenwart von Lactoperoxidase oxidiert. Dabei entsteht am phenolischen A-Ring des Östrogens ein reaktives Phenoxy-Radikal.[54] Durch die Einwirkung von Lactoperoxidase könnten carcinogene Amine so aktiviert werden, dass sie vermehrt mit DNS reagieren und so zur Bildung von Brustkrebs beitragen.[55]
Einzelnachweise
- PDB 2r5l; Singh, A.K., Singh, N., Sharma, S., Kaur, P., Srinivasan, A., Singh, T.P.: Crystal structure of lactoperoxidase at 2.4 Å resolution. In: J. Mol. Biol.. 376, Nr. 1, September 2007, S. 1060–1075. doi:10.2210/pdb2r5l/pdb. PMID 18191143.
- Thomas EL, Bates KP, Jefferson MM: Hypothiocyanite ion: detection of the antimicrobial agent in human saliva. In: J Dent Res. 59, Nr. 9, September 1980, S. 1466–72. doi:10.1177/00220345800590090201. PMID 6931123.
- Tenovuo JO: The peroxidase system in human secretions. In: Tenovuo JO, Pruitt KM (Hrsg.): The Lactoperoxidase system: chemistry and biological significance. Dekker, New York 1985, ISBN 0-8247-7298-9, S. 272.
- Dull TJ, Uyeda C, Strosberg AD, Nedwin G, Seilhamer JJ: Molecular cloning of cDNAs encoding bovine and human lactoperoxidase. In: DNA Cell Biol.. 9, Nr. 7, September 1990, S. 499–509. doi:10.1089/dna.1990.9.499. PMID 2222811.
- Kiser C, Caterina CK, Engler JA, Rahemtulla B, Rahemtulla F: Cloning and sequence analysis of the human salivary peroxidase-encoding cDNA. In: Gene. 173, Nr. 2, September 1996, S. 261–4. doi:10.1016/0378-1119(96)00078-9. PMID 8964511.
- Kohler H, Jenzer H: Interaction of lactoperoxidase with hydrogen peroxide. Formation of enzyme intermediates and generation of free radicals. In: Free Radic Biol Med. 6, Nr. 3, 1989, S. 323–39. doi:10.1016/0891-5849(89)90059-2. PMID 2545551.
- Pruitt KM, Reiter B: Biochemistry of peroxidase systems: antimicrobial effects. In: Tenovuo JO, Pruitt KM (Hrsg.): The Lactoperoxidase system: chemistry and biological significance. Dekker, New York 1985, ISBN 0-8247-7298-9, S. 272.
- Wijkstrom-Frei C, El-Chemaly S, Ali-Rachedi R, Gerson C, Cobas MA, Forteza R, Salathe M, Conner GE: Lactoperoxidase and human airway host defense. In: Am. J. Respir. Cell Mol. Biol.. 29, Nr. 2, August 2003, S. 206–12. doi:10.1165/rcmb.2002-0152OC. PMID 12626341.
- Conner GE, Salathe M, Forteza R: Lactoperoxidase and hydrogen peroxide metabolism in the airway. In: Am. J. Respir. Crit. Care Med. 166, Nr. 12 Pt 2, Dezember 2002, S. S57–61. doi:10.1164/rccm.2206018. PMID 12471090.
- Conner GE, Wijkstrom-Frei C, Randell SH, Fernandez VE, Salathe M: The Lactoperoxidase System Links Anion Transport To Host Defense in Cystic Fibrosis. In: FEBS Lett.. 581, Nr. 2, Januar 2007, S. 271–8. doi:10.1016/j.febslet.2006.12.025. PMID 17204267. PMC 1851694 (freier Volltext).
- Tenovuo JO, Pruitt KM (Hrsg.): The Lactoperoxidase system: chemistry and biological significance. Dekker, New York 1985, ISBN 0-8247-7298-9, S. 272.
- Loimaranta V, Tenuovo J, Korhonen H: Combined inhibitory effect of bovine immune whey and peroxidase-generated hypothiocyanite against glucose uptake by Streptococcus mutans. In: Oral Microbiol Immunol. 13, Nr. 6, 1998, S. 378–381. PMID 9872115.
- de Wit JN, van Hooydonk ACM: Structure, functions and applications of lactoperoxidase in natural antimicrobial systems. In: Netherlands Milk & Dairy Journal. 50, 1996, S. 227–244.
- Wever R, Kast WM, Kasinoedin JH, Boelens R: The peroxidation of thiocyanate catalysed by myeloperoxidase and lactoperoxidase. In: Biochim. Biophys. Acta. 709, Nr. 2, Dezember 1982, S. 212–9. doi:10.1016/0167-4838(82)90463-0. PMID 6295491.
- Pruitt KM, Tenovuo J, Andrews RW, McKane T: Lactoperoxidase-catalyzed oxidation of thiocyanate: polarographic study of the oxidation products. In: Biochemistry. 21, Nr. 3, Februar 1982, S. 562–7. doi:10.1021/bi00532a023. PMID 7066307.
- Thomas EL, Aune TM: Lactoperoxidase, peroxide, thiocyanate antimicrobial system: correlation of sulfhydryl oxidation with antimicrobial action. In: Infection and Immunity. 20, Nr. 2, Mai 1978, S. 456–63. PMID 352945. PMC 421877 (freier Volltext).
- Fweja LW, Lewis MJ, Grandison AS: Challenge testing the lactoperoxidase system against a range of bacteria using different activation agents. In: J. Dairy Sci.. 91, Nr. 7, Juli 2008, S. 2566–74. doi:10.3168/jds.2007-0322. PMID 18565914.
- Courtois P, Majerus P, Labbé M, Vanden Abbeele A, Yourassowsky E, Pourtois M: Susceptibility of anaerobic microorganisms to hypothiocyanite produced by lactoperoxidase. In: Acta Stomatol Belg. 89, Nr. 3, September 1992, S. 155–62. PMID 1481764.
- Haukioja A, Ihalin R, Loimaranta V, Lenander M, Tenovuo J: Sensitivity of Helicobacter pylori to an innate defence mechanism, the lactoperoxidase system, in buffer and in human whole saliva. In: J. Med. Microbiol. 53, Nr. Pt 9, September 2004, S. 855–60. doi:10.1099/jmm.0.45548-0. PMID 15314191.
- Carlsson J, Edlund MB, Hänström L: Bactericidal and cytotoxic effects of hypothiocyanite-hydrogen peroxide mixtures. In: Infect Immun. 44, Nr. 3, Juni 1984, S. 581–6. PMID 6724690. PMC 263633 (freier Volltext).
- Reiter B: The biological significance of lactoferrin. In: Int J Tissue React. 5, Nr. 1, 1983, S. 87–96. PMID 6345430.
- Roger V, Tenovuo J, Lenander-Lumikari M, Söderling E, Vilja P: Lysozyme and lactoperoxidase inhibit the adherence of Streptococcus mutans NCTC 10449 (serotype c) to saliva-treated hydroxyapatite in vitro. In: Caries Res.. 28, Nr. 6, 1994, S. 421–8. doi:10.1159/000262015. PMID 7850845.
- W. James Harper: Biological properties of whey components a review. American Dairy Products Institute, Chicago, IL 2000, S. 54.
- Stanislawski M, Rousseau V, Goavec M, Ito H: Immunotoxins containing glucose oxidase and lactoperoxidase with tumoricidal properties: in vitro killing effectiveness in a mouse plasmacytoma cell model. In: Cancer Res.. 49, Nr. 20, Oktober 1989, S. 5497–504. PMID 2790777.
- Lefkowitz DL, Hsieh TC, Mills K, Castro A: Induction of tumor necrosis factor and cytotoxicity by macrophages exposed to lactoperoxidase and microperoxidase. In: Life Sci.. 47, Nr. 8, 1990, S. 703–9. doi:10.1016/0024-3205(90)90625-2. PMID 2402192.
- Mikola H, Waris M, Tenovuo J: Inhibition of herpes simplex virus type 1, respiratory syncytial virus and echovirus type 11 by peroxidase-generated hypothiocyanite. In: Antiviral Res.. 26, Nr. 2, März 1995, S. 161–71. doi:10.1016/0166-3542(94)00073-H. PMID 7605114.
- Pourtois M, Binet C, Van Tieghem N, Courtois PR, Vandenabbeele A, Thirty L: Saliva can contribute in quick inhibition of HIV infectivity. In: AIDS. 5, Nr. 5, Mai 1991, S. 598–600. doi:10.1097/00002030-199105000-00022. PMID 1650564.
- Reiter B., Härnulv BG: The preservation of refrigerated and uncooled milk by its natural lactoperoxidase system. In: Dairy Ind. Int.. 47, Nr. 5, Januar, S. 13–19.
- Zajac M, Glandys J, Skarzynska M, Härnulv G, Eilertsen K: Milk quality preservation by heat treatment or activation of the lactoperoxidase system in combination with refrigerated storage. In: Milchwissenschaft. 38, Nr. 11, 1983.
- Zajac M, Glandys J, Skarzynska M, Härnulv G, Björck L: Changes in bacteriological quality of raw milk stabilized by activation of its lactoperoxidase system and stored at different temperatures. In: J. Of Food Prot.. 46, Nr. 12, 1983, S. 1065–1068.
- Korhonen H: A new method for preserving raw milk: The lactoperoxidase antibacterial system. In: World Anim. Rev.. 35, 1980, S. 23–29.
- Marks NE, Grandison AS, Lewis MJ: Use of hydrogen peroxide detection strips to determine the extent of pasteurization in whole milk. In: International Journal of Dairy Technology. 54, Nr. 1, 2008, S. 20–22. doi:10.1111/j.0134-727X.2001.00008.x.
- Patentanmeldung WO1988002600: Enzyme-containing bactericidal composition, and dental and wound treatment preparations comprising this composition. Angemeldet am 21. April 1988, Erfinder: Poulson OM.
- Hoogedoorn H: Activation of the salivary peroxidase system: clinical studies. In: Tenovuo JO, Pruitt KM (Hrsg.): The Lactoperoxidase system: chemistry and biological significance. Dekker, New York 1985, ISBN 0-8247-7298-9, S. 217–228.
- Hugoson A, Koch G, Thilander H, Hoogendorn H: Lactoperoxidase in the prevention of plaque accumulation, gingivitis and dental caries (III). In: Odont revy. 25, 1974, S. 69–80. PMID 4522423.
- Midda M, Cooksey MV: Clinical use of an enzyme-containing dentifrice. In: J Clin Periodontol. 13, Nr. 10, 1986, S. 959–956. PMID 3098804.
- Hannig C, Spitzmüller B, Lux HC, Altenburger M, Al-Ahmad A, Hannig M: Efficacy of enzymatic toothpastes for immobilisation of protective enzymes in the in situ pellicle. In: Arch Oral Biol. 55, 2010, S. 463–469. PMID 20417500.
- Hannig C, Hannig M, Attin T: Enzymes in the acquired enamel pellicle. In: Eur J Oral Sci. 113, 2005, S. 2–13. PMID 15693823.
- Jyoti S, Shasikiran ND, Reddy VV: Effect of lactoperoxidase system containing toothpaste on cariogenic bacteria in children with early childhood caries. In: J Clin Pediatr Dent. 33, Nr. 4, 2009, S. 299–303. PMID 19725235.
- van Steenberghe D, Van den Eynde E, Jacobs R, Quirynen M: Effect of a lactoperoxidase containing toothpaste in radiation-induced xerostomia. In: Int Dent J. 44, Nr. 2, 1994, S. 133–138. PMID 15693823.
- Hannig C, Hannig M, Attin T: Enzymes in the acquired enamel pellicle. In: Eur J Oral Sci. 113, 2005, S. 2–13. PMID 15693823.
- Kirstilä V, Lenander-Lumikari M, Tenuovo J: Effects of a lactoperoxidase-system-containing toothpaste on dental plaque and whole saliva in vivo. In: Acta Odontol Scan. 52, Nr. 6, 1994, S. 346–353. PMID 7887144.
- Marino R, Torretta S, Capaccio P, Pignataro L, Spadari F: Different therapeutic strategies for burning mouth syndrome: preliminary data. In: J Oral Pathol Med. 39, Nr. 8, 2010, S. 611–616. doi:10.1111/j.1600-0714.2010.00922.x. PMID 20701667.
- Shin K, Yaegaki K, Murata T, Ii H, Tanaka T, Aoyama I, Yamauchi K, Toida T, Iwatsuki K: Effects of a composition containing lactoferrin and lactoperoxidase on oral malodor and salivary bacteria: a randomized, double-blind, crossover, placebo-controlled clinical trial. In: Clin Oral Investig. 15, Nr. 4, 2011, S. 485–493. PMID 20512389.
- Gil-Montoya JA, Guardia-Lopéz I, Gonzaléz-Moles MA: Evaluation of the clinical efficacy of a mouthwash and oral gel containing the antimicrobial proteins lactoperoxidase, lysozyme and lactoferrin in elderly patients with dry mouth – a pilot study. In: Gerodontology. 25, Nr. 1, 2008, S. 3–9. PMID 18194332.
- Nagy K, Urban E, Fazwkas O, Thurzo L, Nagy E: Controlled study of lactoperoxidase gel on oral flora and saliva in irradiated patients with oral cancer. In: J Craniofac Surg. 18, Nr. 5, 2007, S. 1157–1164. PMID 17912104.
- Shahdad SA, Taylor C, Barclay SC, Steeb IN, Preshaw PM: A double-blind, crossover study of Biotène Oralbalance and BioXtra systems as salivary substitutes in patients with post- radiotherapy xerostomia. In: Eur J Cancer Care. 14, Nr. 4, 2005, S. 319–326. PMID 16098116.
- Matear DW, Barbaro J: Effectiveness of saliva substitute products in the treatment of dry mouth in the elderly: a pilot study. In: J R Soc Promot Health. 125, Nr. 1, 2005, S. 35–41. PMID 15712851.
- Xu Y, Szép S, Lu Z: The antioxidant role of thiocyanate in the pathogenesis of cystic fibrosis and other inflammation-related diseases. In: Proc. Natl. Acad. Sci. U.S.A.. 106, Nr. 48, Dezember 2009, S. 20515–9. doi:10.1073/pnas.0911412106. PMID 19918082. PMC 2777967 (freier Volltext).
- Moskwa P, Lorentzen D, Excoffon KJ, Zabner J, McCray PB, Nauseef WM, Dupuy C, Bánfi B: A Novel Host Defense System of Airways Is Defective in Cystic Fibrosis. In: Am. J. Respir. Crit. Care Med. 175, Nr. 2, Januar 2007, S. 174–83. doi:10.1164/rccm.200607-1029OC. PMID 17082494. PMC 2720149 (freier Volltext).
- Minarowski Ł, Sands D, Minarowska A, Karwowska A, Sulewska A, Gacko M, Chyczewska E: Thiocyanate concentration in saliva of cystic fibrosis patients. In: Folia Histochem. Cytobiol.. 46, Nr. 2, 2008, S. 245–6. doi:10.2478/v10042-008-0037-0. PMID 18519245.
- Sipe HJ, Jordan SJ, Hanna PM, Mason RP: The metabolism of 17 alpha-estradiol by lactoperoxidase: a possible source of oxidative stress in breast cancer. In: Carcinogenesis. 15, Nr. 11, November 1994, S. 2637–43. doi:10.1093/carcin/15.11.2637. PMID 7955118.
- Ghibaudi EM, Laurenti E, Beltramo P, Ferrari RP: Can estrogenic radicals, generated by lactoperoxidase, be involved in the molecular mechanism of breast carcinogenesis?. In: Redox Rep.. 5, Nr. 4, 2000, S. 229–35. doi:10.1179/135100000101535672. PMID 10994878.
- Løvstad RA: A kinetic study on the lactoperoxidase catalyzed oxidation of estrogens. In: Biometals. 19, Nr. 6, Dezember 2006, S. 587–92. doi:10.1007/s10534-006-0002-3. PMID 16944280.
- Gorlewska-Roberts KM, Teitel CH, Lay JO, Roberts DW, Kadlubar FF: Lactoperoxidase-catalyzed activation of carcinogenic aromatic and heterocyclic amines. In: Chemical Research in Toxicology. 17, Nr. 12, Dezember 2004, S. 1659–66. doi:10.1021/tx049787n. PMID 15606142.