Tetramethylzinn
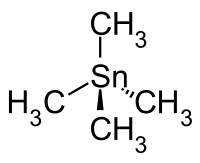
Tetramethylzinn, mit der Konstitutionsformel Sn(CH3)4, ist eine der einfachsten metallorganischen Zinnverbindungen. Die klare, farblose, dünnflüssige, leicht flüchtige Flüssigkeit hat einen unangenehmen Geruch.[4] Tetramethylzinn kann zur Methylierung von organischen und anorganischen Halogeniden verwendet werden.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Tetramethylzinn | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4H12Sn | |||||||||||||||
| Kurzbeschreibung |
niedrigviskose, brennbare, farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 178,848 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte |
1,29 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
74–75 °C[1] (ohne Zersetzung) | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser (0,06 g·l−1)[2], löslich in unpolaren Lösemitteln | |||||||||||||||
| Brechungsindex |
1,441 (bei 20 °C, 589 nm)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
0,001 ml·m−3, 0,005 mg·m−3[2] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Gewinnung und Darstellung
Tetramethylzinn kann durch Reaktion des Grignard-Reagenz Methylmagnesiumiodid mit Zinn(IV)-chlorid (SnCl4) hergestellt werden:[5]
Auch metallorganische Verbindungen anderer Elemente, wie Methylaluminiumverbindungen, können zur Methylierung von SnCl4 eingesetzt werden.[6]
Ebenso können SnCl4 und Methylchlorid direkt in Gegenwart von Natrium miteinander umgesetzt werden (Wurtz-Reaktion):[6]
Eigenschaften
Physikalische Eigenschaften
Tetramethylzinn ist leichtentzündlich, mit einem Flammpunkt von −12 °C und einer unteren Explosionsgrenze von 1,9 Vol-%.[1] Es hat eine Dichte von 1,29 g·cm−3 und einen Brechungsindex von 1,4410. Es ist nahezu unlöslich in Wasser aber gut mischbar mit unpolaren organischen Lösungsmitteln. Im Molekül ist das zentrale Zinnatom – äquivalent zum zentralen Kohlenstoffatom in Neopentan – von den vier Methylgruppen in einer tetraedrischen Anordnung umgeben. Die Stärke der Sn–C-Bindung wird mit 297 kJ/mol angenommen.[7]
Chemische Eigenschaften
Tetramethylzinn ist aufgrund der guten Abschirmung des zentralen Metallatoms und der geringen Polarität der Sn–C-Bindung an der Luft stabil und weitgehend hydrolyseunempfindlich. Tetramethylzinn reagiert mit Säurechloriden unter Bildung von Methylketonen und mit Arylhalogeniden unter Bildung von Arylmethylketonen:
Auch auf anorganische Halogenide, wie SnCl4 oder BBr3, können vom Tetramethylzinn Methylgruppen übertragen werden:
Verwendung
- im MOCVD-Verfahren (Metalorganic Chemical Vapour Deposition) bei der Herstellung von hochwertigen Zinn oder Zinnoxidfilmen für Solarzellen oder Gassensoren durch thermische Zersetzung bei 400–650 °C.[7][9][10]
- als Cokatalysator bei der Polymerisation von Cycloolefinen (Metathese). Im ersten Schritt bilden sich die entsprechenden aktiven Wolfram-Katalysatoren[11][12], Methyltrioxorhenium (MTO)[13] oder andere Rheniumkatalysatoren durch Methylierung des Zentralatoms:[14]
Sicherheitshinweise
Tetramethylzinn ist wie viele andere organische Zinnverbindungen als giftig eingestuft und muss daher mit entsprechender Vorsicht gehandhabt werden.
- Toxizität gegenüber Fischen, LC50: Dosis 6,44 mg/l (48 h) Oryzias latipes (Roter Killifisch).
- Toxizität gegenüber Daphnien und anderen wirbellosen Wassertieren, EC50: Dosis: 40 mg/l (24 h) Daphnia magna (Großer Wasserfloh).[1]
Zinnorganische Verbindungen schädigen das zentrale Nervensystem, was zu Krämpfen, Narkose und Atemlähmung führen kann. Es wird berichtet, dass Tetramethylzinn, welches – neben Triethyl- und Trimethylzinnverbindungen – bei der Produktion von Solarzellen eingesetzt wird, in Säugetieren rasch zu Trimethylzinn-Einheiten dealkyliert wird. Tierversuche zeigen, dass Trimethylzinn auf das zentrale Nervensystem wirkt und zu Vergiftungen führen kann, welche sich in reversiblen Nervenschäden bis zum Tod manifestieren können.[15]
Nachweis
| Methode | Eigenschaft/Signal |
|---|---|
| NMR[5] | 1H-NMR δ = 0,1 ppm; 13C-NMR δ = −9,5 ppm; 119Sn-NMR δ = 0 ppm (allgemeinüblicher Standard) |
| MS[16] | Tetramethylzinn zerfällt im Massenspektrum als erstes unter Bildung des Fragmentes +Sn(CH3)3, welches eine Gruppe von Signalen, entsprechend der Isotopenverteilung des Zinns, zeigt. Das Molekülion +Sn(CH3)4 wird nicht detektiert. Weitere Fragmente sind +Sn(CH3)2, +SnCH3 und Sn+ |
Literatur
- Alwyn George Davies, Keith Pannell: Tin chemistry: fundamentals, frontiers, and applications. John Wiley & Sons Ltd, 2008, ISBN 978-0-470-51771-0 (Seite 1 in der Google-Buchsuche).
Einzelnachweise
- Datenblatt Tetramethylzinn zur Synthese (PDF) bei Merck, abgerufen am 13. November 2011.
- Methylzinnverbindungen. In: DFG (Hrsg.): The MAK Collection for Occupational Health and Safety. 2014, S. 13, doi:10.1002/3527600418.mb744031metd0056.
- Eintrag zu Tetramethylzinn in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Wolfgang Legrum: Riechstoffe, zwischen Gestank und Duft, Vieweg + Teubner Verlag (2011) S. 68–69, ISBN 978-3-8348-1245-2.
- Scott, W. J.; Jones, J. H.; Moretto, A. F.: Tetramethylstannane. In: Encyclopedia of Reagents for Organic Synthesis. 2002. doi:10.1002/047084289X.rt070.
- Alwyn George Davies: Organotin chemistry, Band 1. Wiley-VCH Verlag GmbH & Co. KGaA, 2004, ISBN 3-527-31023-1 (Seite 46–48 in der Google-Buchsuche).
- Roland A. Fischer: Precursor chemistry of advanced materials. Springer-Verlag Berlin, 2005, ISBN 978-3-540-01605-2 (Seite 7 in der Google-Buchsuche).
- Alwyn George Davies: Organotin chemistry, Band 1. Wiley-VCH Verlag GmbH & Co. KGaA, 2004, ISBN 3-527-31023-1 (Seite 167 in der Google-Buchsuche).
- Yuichiro Okajima et al.: Proceedings of the Third International Symposium on Ceramic Sensors. The Electrochemical Society Inc., 1997, ISBN 1-56677-127-7 (Seite 69 in der Google-Buchsuche).
- Cynthia J. Bruckner-Lea: Chemical sensors 6. The Electrochemical Society Inc., 2004, ISBN 1-56677-421-7 (Seite 42 in der Google-Buchsuche).
- Manfred Dieter Lechner, Klaus Gehrke, Eckhard H. Nordmeier: Makromolekulare Chemie: ein Lehrbuch für Chemiker, Physiker. Birkhäuser Verlag, 2010, ISBN 978-3-7643-8890-4 (Seite 100 in der Google-Buchsuche).
- Christoph Janiak, Thomas M. Klapötke, Hans-Jürgen Meyer, Erwin Riedel: Moderne anorganische Chemie. de Gruyter, 2003, ISBN 3-11-017838-9 (Seite 741 in der Google-Buchsuche).
- Patent WO2010075972A2: METHOD FOR PRODUCING METHYL TRIOXORHENIUM (MTO).
- Patent DE3940196A1: Organo-rhenium oxide cpds. - useful on oxide support materials, as catalysts for metathesis of olefin(s), esp. functional olefin(s).
- L. D. Hamilton, W. H. Medeiros, P. D. Moskowitz, K. Rybicka: Toxicology of tetramethyltin and other organometals used in photovoltaic cell manufacture, AIP Conf. Proc., 1988, Volume 166, Issue 1, S. 54–66; doi:10.1063/1.37131.
- Catherine E. Housecroft, Edwin C. Constable: Chemistry. Pearson Education Limited, 2010, ISBN 978-0-273-71545-0 (Seite 367 in der Google-Buchsuche).


