Tellurtetraiodid
Tellurtetraiodid ist eine anorganische chemische Verbindung des Tellurs aus der Gruppe der Iodide.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
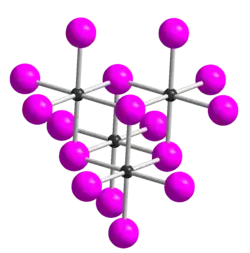 | |||||||||||||||||||
| _ Te4+ _ I− Te4I16-Einheit in der Kristallstruktur von TeI4 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Tellurtetraiodid | ||||||||||||||||||
| Andere Namen |
Tellur(IV)-iodid | ||||||||||||||||||
| Verhältnisformel | TeI4 | ||||||||||||||||||
| Kurzbeschreibung |
grauer bis schwarzer Feststoff mit beißendem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 635,22 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
5,403 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
Zersetzung in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Tellurtetraiodid kann durch Reaktion von Tellursäure mit Iodwasserstoff gewonnen werden.[2]
Es kann auch durch Reaktion von Tellur und Iod gewonnen werden, wobei je nach Reaktionsbedingungen auch Tellurdiiodid und Tellurmonoiodid entstehen können.[3]
Eigenschaften
Tellurtetraiodid ist ein eisengrauer Feststoff, der sich in kaltem Wasser langsam, in warmem Wasser rasch zu Tellurdioxid und Iodwasserstoff zersetzt.[1] Er ist beständig auch an feuchter Luft und zersetzt sich beim Erhitzen unter Iod-Abgabe. Er ist löslich in Iodwasserstoffsäure unter Bildung von H[TeI5] und etwas löslich in Aceton.[2] Von Tellurtetraiodid sind fünf Modifikationen bekannt, die alle aus tetrameren Molekülen aufgebaut sind.[4] Die δ-Form ist die thermodynamisch stabilste Form. Diese leitet sich (wie auch die α-,β- und γ-Form) strukturell von der ε-Form ab. Diese besitzt eine Struktur vom Kuban-Typ, die sich als aus vier über Halogenidbrücken verknüpften TeI3+I−-Einheiten zusammengesetzt beschreiben lässt. Die Formen unterscheiden sich dadurch, dass eine TeI3-Ecke des Würfels verschoben ist.[5]
Einzelnachweise
- Datenblatt Tellurium(IV) iodide, 99% (metals basis) bei AlfaAesar, abgerufen am 17. Dezember 2013 (PDF) (JavaScript erforderlich).
- Georg Brauer, unter Mitarbeit von Marianne Baudler u. a. (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I. Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 435.
- J. J. Zuckerman: Inorganic Reactions and Methods, The Formation of Bonds to Halogens. John Wiley & Sons, 2009, ISBN 0-470-14538-2, S. 59 (eingeschränkte Vorschau in der Google-Buchsuche).
- Erwin Riedel, Christoph Janiak: Anorganische Chemie. Walter de Gruyter, 2011, ISBN 3-11-022567-0, S. 461 (eingeschränkte Vorschau in der Google-Buchsuche).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 632.

