Tellurtetrachlorid
Tellurtetrachlorid ist eine anorganische chemische Verbindung des Tellurs aus der Gruppe der Chloride.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| _ Te4+ _ Cl− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Tellurtetrachlorid | |||||||||||||||
| Andere Namen |
Tellur(IV)-chlorid | |||||||||||||||
| Verhältnisformel | TeCl4 | |||||||||||||||
| Kurzbeschreibung |
gelber Feststoff mit stechendem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 269,41 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
3,01 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
380 °C[1] | |||||||||||||||
| Löslichkeit |
Zersetzung in Wasser unter Bildung von TeO2 und Chlorwasserstoff[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Tellurtetrachlorid kann durch Reaktion von Tellur mit Chlor gewonnen werden.[2]
Eigenschaften
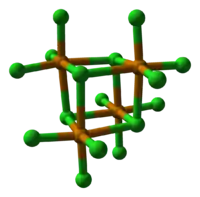
Tellurtetrachlorid ist ein feuchtigkeitsempfindlicher weißer bis gelber Feststoff mit stechendem Geruch, der sich in Wasser unter Bildung von Tellurdioxid und Chlorwasserstoff zersetzt.[1] Er zerfließt an feuchter Luft unter teilweiser hydrolytischer Zersetzung und ist löslich in Ethanol und Toluol. Seine Schmelze ist gelb gefärbt, der Dampf orangerot.[2] Ab etwa 500 °C zersetzt sich die Verbindung unter Chlorabgabe, wobei die Zersetzung bei 1000 °C vollständig ist. Im gasförmigen Zustand ist die Struktur monomer und entspricht der von Schwefeltetrafluorid. Im festen Zustand besitzt sie eine Struktur vom Kuban-Typ die sich als aus vier über Halogenidbrücken verknüpften TeCl3+Cl−-Einheiten zusammengesetzt beschreiben lässt.[3] Die Kristallstruktur hat monokline Symmetrie, Raumgruppe C2/c (Raumgruppen-Nr. 15), mit den Gitterparametern a = 17,076 Å, b = 10,404 Å, c = 15,252 Å und β = 116,82°.[4]

Verwendung
Tellurtetrachlorid kann für Synthesen in der organischen Chemie verwendet werden.[5]
Einzelnachweise
- Datenblatt Tellurium(IV) chloride, 99.9% (metals basis) bei AlfaAesar, abgerufen am 9. Dezember 2013 (PDF) (JavaScript erforderlich).
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 432.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 632.
- B. Buss, B. Krebs: The Crystal Structure of Tellurium Tetrachloride. In: Inorganic Chemistry. 10, 1971, S. 2795–2800, doi:10.1021/ic50106a035.
- N. Petragnani, J. V. Comasseto: Tellurium Reagents in Organic Synthesis; Recent Advances. Part 1. In: Synthesis. (10), 1991, S. 793–817. doi:10.1055/s-1991-26577. und …Part 2. In: Synthesis. (11), 1991, S. 897–919. doi:10.1055/s-1991-26605
