Tellursäure
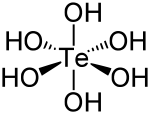
Tellursäure ist eine sehr schwache Säure des Tellurs. Die geringe Acidität ist auf die Struktur zurückzuführen. Die negative Ladung im Anion kann nicht delokalisiert werden. Tellur hat in der Verbindung die Oxidationsstufe VI.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Tellursäure | |||||||||||||||
| Andere Namen |
Orthotellursäure | |||||||||||||||
| Summenformel | H6TeO6 | |||||||||||||||
| Kurzbeschreibung |
farbloses Pulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 229,66 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
3,16 g·cm−3 [2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| pKS-Wert |
7,70 (pKs1); 10,95 (pKs2)[4] | |||||||||||||||
| Löslichkeit |
mäßig in Wasser (100 g·l−1 bei 20 °C)[5] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Herstellung
Tellursäure erhält man aus feinverteiltem Tellur und wässriger Chlorsäure-Lösung, durch Oxidation von Tellurdioxid mit Kaliumpermanganat in Salpetersäure, durch Oxidation von Tellur oder Tellurdioxid mit Wasserstoffperoxid oder durch Oxidation von Tellur mit Salpetersäure und Chromtrioxid.[6]
Eigenschaften
Tellursäure ist oktaedrisch aufgebaut und wird auch Orthotellursäure genannt. Sie bildet farblose, wasserlösliche Kristalle. Da bereits die 1. Dissoziationsstufe von Tellursäure sehr klein ist und die letzte (6.) demnach verschwindend klein, existieren die meisten Tellurate (Salze) nur als Hydrogentellurate, jedoch existiert Silbertellurat, Ag6TeO6. Das Anhydrid der Tellursäure, Tellurtrioxid (TeO3), ist ein gelbes Kristallpulver. Tellursäure und (wasserlösliche) Tellurate sind giftig und wirken sehr stark oxidierend.[4] Tellursäure kommt in einer monoklinen und einer kubischen Modifikation vor. Große Kristalle sind gewöhnlich monoklin, während mikrokristalline Pulver häufig aus einer Mischung beider Formen bestehen. Beim Erhitzen geht die Verbindung zwischen 100 und 220 °C in feste, wasserunlösliche Polymetatellursäure über, die oberhalb 220 °C in Tellurtrioxid und ab 400 °C in Tellurdioxid und Sauerstoff zerfällt. Im geschlossenen Rohr schmilzt Tellursäure bei etwa 136 °C unter Bildung einer konzentrierten wässrigen Lösung von Polymetatellursäure und etwas Orthosäure.[7]
Einzelnachweise
- Frank C. Mathers et al.: Telluric acid. In: Ludwig F. Audrieth (Hrsg.): Inorganic Syntheses. Band 3. McGraw-Hill, Inc., 1950, S. 145–147 (englisch).
- Claudia Synowietz (Hrsg.): Taschenbuch für Chemiker und Physiker. begründet von Jean d’Ans, Ellen Lax. 4. Auflage. Band II: Organische Verbindungen. Springer, Berlin 1983, ISBN 3-540-12263-X.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 634.
- Datenblatt Telluric acid bei Sigma-Aldrich, abgerufen am 3. Oktober 2016 (PDF).
- G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 451–3.
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 439.
