Polyacrylamid-Gelelektrophorese
Die Polyacrylamid-Gelelektrophorese (PAGE) ist in der Biochemie eine Methode zum Auftrennen von Molekülen, insbesondere von Proteinen und Nukleinsäuren.


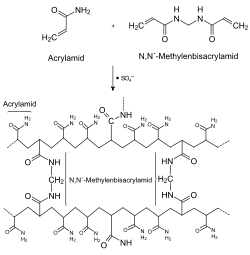
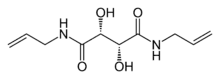
Herstellung von Sammel- und Trenngel
Für die Elektrophorese wird das Gel durch radikalische Polymerisation aus den Stoffen Acrylamid und N,N′-Methylenbisacrylamid (gewöhnlich im Verhältnis 37,5:1) hergestellt. Letzteres dient zur Quervernetzung der ansonsten linearen Polyacrylamid-Ketten. Nur so entsteht ein starres Gel. Der durchschnittliche Porendurchmesser eines Polyacrylamidgels wird durch zwei Parameter bestimmt, die Gesamtkonzentration an Acrylamiden (%T mit T = Totale Konzentration von Acrylamid und Bisacrylamid) und die Konzentration des Vernetzers Bisacrylamid (%C mit C = Bisacrylamidkonzentration).[1] Die Porengröße ist umgekehrt proportional zu %T. Mit steigendem %T nimmt die Porengröße ab. Bei %C ergibt eine Konzentration von 5 % die kleinsten Poren. Der Einfluss des Bisacrylamids auf die Porengröße ergibt eine Parabel-förmige Kurve mit dem Vertex bei 5 %.
Wenn man an Stelle von N,N′-Methylenbisacrylamid N,N′-Diallyltartardiamid verwendet, dann kann man das Gel nach dem Trennlauf mit Natriumperiodatlösung durch Glycolspaltung wieder auflösen, was die Untersuchung der getrennten Substanzen erleichtert.
Das Gel besteht aus einem Trenngel, über das eine niedrige Schicht Sammelgel pipettiert wird. Die Mischungen für beide werden zunächst je nach gewünschter Zusammensetzung getrennt voneinander vorbereitet. Der pH-Wert des eingesetzten Puffers, die Konzentration von Acrylamid und der Gehalt an Bisacrylamid in der Ausgangsmischung bestimmen die Trenneigenschaften des Gels. Bei einer diskontinuierlichen Elektrophorese werden verschiedene Puffer zur Herstellung von einem Sammelgel und einem Trenngel verwendet.
Die Trenngel-Mischung wird mit dem Radikalstarter Ammoniumperoxodisulfat (APS) sowie dem Polymerisierungskatalysator Tetramethylethylendiamin (TEMED) versetzt und zügig zwischen zwei abgedichtete Glasplatten gegossen, die durch einen Abstandhalter (Spacer) voneinander getrennt sind (der Abstand beträgt etwa 1,5 mm). Dabei dürfen keine Bläschen im Gel verbleiben. Die Scheiben müssen absolut sauber und fettfrei sein. Das Trenngel wird schließlich mit etwas Wasser, Isopropanol oder Butanol überschichtet, um zum einen eine Glättung der Gelgrenze zu erreichen und zum anderen den Kontakt mit Sauerstoff auszuschließen, da der Luftsauerstoff die zur Polymerisation notwendigen Radikale abfangen und somit eine korrekte Polymerisation des Gels stören würde.
Wenn man an Stelle von Ammoniumperoxodisulfat Riboflavin verwendet, dann kann man mit Hilfe von hellem, blau-violettem Licht den Zeitpunkt der Polymerisation selbst bestimmen, was einen größeren zeitlichen Spielraum für das Gießen des Gels erlaubt.
Die Giftigkeit des unpolymerisierten Acrylamids macht außerdem die Verwendung von Handschuhen erforderlich. Nach dem vollständigen Auspolymerisieren ist das Gel allerdings weitgehend gesundheitlich unbedenklich. Die Zeit, die das Gel braucht um auszupolymerisieren, ist abhängig von der Konzentration des Radikalstarters und des Polymerisierungskatalysators. Sobald die Polymerisation abgeschlossen ist kann das Wasser bzw. der Alkohol abgegossen oder abgesaugt werden. Danach wird das Sammelgel mit APS und TEMED versetzt und über das Trenngel pipettiert. Um Taschen zum Einfüllen der Proben zu erhalten, wird ein spezieller Kamm eingesteckt. Eine Überschichtung mit Wasser/Alkohol ist dank des eingesteckten Kammes überflüssig. Nach der Auspolymerisierung kann der Kamm entfernt werden.
Verfahrensweise
Das fertige Polyacrylamid-Gel wird in eine Elektrophorese-Apparatur eingespannt.
In die ausgesparten Taschen werden die Proben pipettiert. Eine Tasche wird meistens mit einer Referenz, z. B. einem Proteinstandard, der mehrere Proteine bekannter Größe beinhaltet, befüllt. Es wird zudem ein sichtbarer, negativ geladener Farbstoff (z. B. Bromphenolblau) zugesetzt.
Da die zu trennenden Moleküle eine Ladung besitzen, werden sie beim Anlegen einer Spannung (10 bis 20 V/cm Gellänge bei 1 mm Dicke) durch das Polymer "gezogen" und abhängig von Ladung, Größe, Molmasse und Beschaffenheit des Trennmediums elektrophoretisch aufgetrennt (siehe Gelelektrophorese).
Die Gittergröße wird durch die Konzentration des Acrylamids bestimmt. Zur Auftrennung von größeren Molekülen ist eine geringere Konzentration Acrylamid erforderlich als für kleinere.
Die Elektrophorese wird beendet, sobald der Farbstoff das Gel durchlaufen hat. Anschließend werden die Protein-Banden im Gel durch Färbung sichtbar gemacht (Coomassiefärbung oder Silberfärbung).
Anwendungen
Acrylamid-Gele eignen sich zur Auftrennung von Proteinen mit Molmassen zwischen 1 und 500 kDa.
Es existieren verschiedene Varianten der PAGE:
Die Kombination einer isoelektrischen Fokussierung oder einer BAC-PAGE mit einer SDS-PAGE wird als 2D-Gelelektrophorese bezeichnet. Als alternative Matrix mit deutlich größeren Porendurchmessern wird in einer Agarose-Gelelektrophorese Agarose verwendet.
Weblinks
Einzelnachweise
- Reinhard Rüchel, Russell L. Steere, Eric F. Erbe: Transmission-electron microscopic observations of freeze-etched polyacrylamide gels. In: Journal of Chromatography A. 166, 1978, S. 563, doi:10.1016/S0021-9673(00)95641-3.