Sulfurylfluorid
Sulfurylfluorid ist ein farb- und geruchloses Gas, das als Insektizid bei Lebensmitteln wie Getreide, Nüssen, Schalen- und Trockenfrüchten verwendet wird. Des Weiteren dient es zur Bekämpfung von Holzschädlingen in Gegenständen, Räumen oder Gebäuden. Das Gas hat ein hohes Treibhauspotential.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
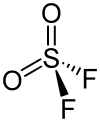 | |||||||||||||||||||
| Keile zur Verdeutlichung der räumlichen Struktur | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Sulfurylfluorid | ||||||||||||||||||
| Andere Namen |
Sulfuryldifluorid | ||||||||||||||||||
| Summenformel | SO2F2 | ||||||||||||||||||
| Kurzbeschreibung |
farbloses, geruchloses, giftiges Gas[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 102,06 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||||||||
| Dichte |
4,63 kg·m−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
−55,4 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
wenig löslich[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Treibhauspotential |
4732 (bezogen auf 100 Jahre)[5] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Geschichte
Sulfurylfluorid wurde Anfang der 1950er-Jahre als Begasungsmittel zur Vernichtung von Holzschädlingen entwickelt und wird seit 1961 in den USA vertrieben.
Mit der Verabschiedung des Montreal-Protokolls im Jahr 1987 wurde der Einsatz des Schädlingsbekämpfungsmittels Methylbromid eingeschränkt, da es die Ozonschicht schädigt. Dadurch erweiterte sich der Einsatzbereich von Sulfurylfluorid, das keine Wirkung auf die Ozonschicht hat.[6] Nach neueren atmosphärischen Messungen wird jedoch ein berechnetes Treibhauspotential von 4780 vermutet.[7] 2015 betrug der Einsatz von Sulfurylfluorid in Hamburg 16,68 Tonnen. Laut angezeigten Begasungen wurden in Hamburg 2019 im Zusammenhang mit Holzexporten des Hamburger Hafens 203,65 Tonnen eingesetzt, was unter Berücksichtigung des Treibhauspotentials ca. 950.000 Tonnen CO2-Äquivalenten entspricht.[8] Im ersten Halbjahr 2020 betrug der Einsatz 102,22 Tonnen.[9] Bei einer Begasung der Kirche St. Veit in Ursensollen kam es 2009 zu einem tödlichen Unfall[10][11].
Zulassung in Deutschland
Unter dem Handelsnamen ProFume erhielt Dow AgroSciences die Zulassung für Sulfurylfluorid durch das Bundesamt für Verbraucherschutz und Lebensmittelsicherheit (BVL). Diese erlaubte 2007 zunächst nur die Anwendung bei Trockenobst sowie zur Desinfektion leerer Mühlen und Räume.[12] Eine zweite Zulassung 2009 umfasste auch die Behandlung von Nüssen, Walnüssen und Schalenfrüchten sowie für verschiedene Getreidearten, die in Lagern oder unter gasdichten Planen bis zur Weiterverarbeitung gelagert werden.[13] 2012 erfolgte die Zulassung zur Schädlingsbekämpfung zur Behandlung von Laub- und Nadelholz, Holzpaletten und Packholz.[14][15]
| Anwendung | min. Reinheitsgrad | maximale Gaskonzentration pro Anwendung | maximale Gaskonzentration pro Jahr | Anwendungen pro Jahr | EU-Grenzwert Fluorid |
|---|---|---|---|---|---|
| leere Räume, Silos, Mühlen | 99,4 % | 128 g/m3 | 384 g/m3 | 3 | |
| Trockenobst | 99,4 % | 128 g/m3 | 384 g/m3 | 3 | 3 mg/kg |
| Getreide (Gerste, Hafer, Roggen, Triticale, Weizen) | 99,4 % | 128 g/m3 | 128 g/m3 | 1 | 2 mg/kg |
| Schalenobst (Nüsse) | 99,4 % | 128 g/m3 | 384 g/m3 | 3 | 25 mg/kg |
Biologische Wirkung auf Lebewesen
Sulfurylfluorid setzt in biologischem Material Fluoridionen frei. Diese hemmen die Glykolyse und den Fettsäurezyklus in den Zellen der Zielspezies. Dem betroffenen Organismus fehlt somit die zum Überleben benötigte Energie.[16]
Fluoridrückstände in Lebensmitteln
In der Zulassung des Bundesamtes für Verbraucherschutz und Lebensmittelsicherheit (BVL) wird angenommen, dass bei Anwendung die EU-Höchstwerte für Fluorid von 25 mg/kg für Nüsse und 3 mg/kg bei Trockenobst eingehalten werden könnten, jedoch wird darauf hingewiesen, dass bei einer „Ausweitung der Anwendung“ in Verbindung mit anderen Fluoridquellen wie z. B. Zahnpasta eine Neubewertung notwendig würde. Weiter warnt das BVL, dass nun unter Berücksichtigung aller Aufnahmepfade für Fluorid eine Überschreitung der maximal tolerierbaren Gesamtdosis nicht ausgeschlossen werden könne.[13]
Erderwärmende Wirkung
Sulfuryldifluorid besitzt ein Treibhauspotential im Vergleich zur gleichen Masse CO2 von 4780 bezogen auf 100 Jahre bei einer Verweilzeit von 36 Jahren in der Atmosphäre.[17]
Im Hamburger Hafen steigen seit dem Jahr 2018 die Emissionen von Sulfuryldifluorid deutlich an (2017: 19 Tonnen, 2018: 51 Tonnen, 2019: 204 Tonnen).[18] Der Grund dafür ist die Nutzung als Desinfektionsmittel beim Export von Holz. Die steigenden Emissionen wurden laut einem Bericht des Spiegel von Mitarbeitern der Hamburger Umweltbehörde bemerkt und an das Bundesumweltministerium gemeldet.[19]
Gewinnung und Darstellung
Sulfurylfluorid kann dargestellt werden durch
- Umsetzung von Schwefeldioxid mit Fluor[20]
- Zersetzung des Bariumsalzes der Fluorsulfonsäure[20]
- Metathese von Sulfurylchlorid mit Natriumfluorid
- Umsetzung von Bariumchlorid mit Fluorsulfonsäure
- einwirken von Schwefel(IV)-oxid auf Silber(II)-fluorid in Analogie zum Carbonylfluorid[21]
- Reaktion von Sulfurylchloridfluorid mit Kaliumfluorosulfit[22]
Eigenschaften
Physikalische Eigenschaften
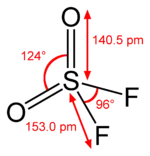
Sulfurylfluorid ist bisphänoid (verzerrt tetraedisch) aufgebaut, das Schwefelatom sitzt in der Tetraedermitte.[23]
Chemische Eigenschaften
Laut WHO und EPA gehört Sulfurylfluorid zu den hochreaktiven Stoffen[24]. Im Vergleich zu Sulfurylchlorid ist es jedoch reaktionsträger und thermisch stabiler. In Wasser tritt bis 150 °C keine signifikante Hydrolyse ein[21], bei basischen pH-Werten hydrolysiert es jedoch bereits bei Raumtemperatur zu Fluorid, Sulfat und Wasser. Der wichtigste Abbauweg in der Umwelt ist die Hydrolyse, die mit Halbwertszeiten (DT50) zwischen wenigen Minuten und wenigen Tagen erfolgt.[13]
| pH | Temperatur | DT50[13] |
|---|---|---|
| 2 | 25 °C | 5,3 d |
| 7 | 25 °C | 4,6 h |
| 9 | 25 °C | 2,8 min |
Einzelnachweise
- Eintrag zu Sulfuryldifluorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Eintrag zu Sulphuryl difluoride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- BMWA Österreich: Stoffliste der MAK- und TRK-Werte, Anhang I/2007.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 2699-79-8 bzw. Sulfurylfluorid), abgerufen am 2. November 2015.
- G. Myhre, D. Shindell et al.: Climate Change 2013: The Physical Science Basis. Working Group I contribution to the IPCC Fifth Assessment Report. Hrsg.: Intergovernmental Panel on Climate Change. 2013, Chapter 8: Anthropogenic and Natural Radiative Forcing, S. 24–39; Table 8.SM.16 (PDF).
- Arbeitsgemeinschaft Getreideforschung e.V.: Neue Begasungsmittel (Memento vom 2. Februar 2010 im Internet Archive).
- V. C. Papadimitriou et al.: Experimental and Theoretical Study of the Atmospheric Chemistry and Global Warming Potential of SO2F2. In: J. Phys. Chem. A, 2008, 112, S. 12657–12666, doi:10.1021/jp806368u.
- Schriftliche Kleine Anfrage: Begasung mit Sulfurylfluorid, Parlamentsdatenbank der Hamburgischen Bürgerschaft, 10. Januar 2020, S. 3, Drucksache 21/19518.
- Schriftliche Kleine Anfrage: Noch mehr Sulfurylfluorid?, Parlamentsdatenbank der Hamburgischen Bürgerschaft, 27. Oktober 2020, S. 2, Drucksache 22/1819.
- Reiner Metzger: Ein Toter neben der begasten Kirche. In: Die Tageszeitung: taz. 22. Oktober 2002, ISSN 0931-9085, S. 9 (taz.de [abgerufen am 13. Dezember 2021]).
- Der Tod kam für den 39-jährigen Familienvater aus dem oberpfälzischen Ursensollen heimtückisch und ohne Vorwarnung. Merkur.de vom 29. März 2009, abgerufen am 23. Juli 2020.
- Bundesamt für Verbraucherschutz und Lebensmittelsicherheit: PSM-Zulassungsbericht ProFume 02395-00-00, 26 September 2007.
- Bundesamt für Verbraucherschutz und Lebensmittelsicherheit: PSM-Zulassungsbericht ProFume 02395-00-01, 15. Juli 2009.
- Bundesamt für Verbraucherschutz und Lebensmittelsicherheit: PSM-Zulassungsbericht ProFume 02395-00-2, 10. Mai 2012.
- Bundesamt für Verbraucherschutz und Lebensmittelsicherheit: PSM-Zulassungsbericht ProFume 02395-00-03, 24 April 2012.
- Pesticide residues in food - REPORT 2005, World Health Organization, Food and Agriculture Organization of the United Nations, Rome, 2005.
- Vassileios C. Papadimitriou, R. W. Portmann, David W. Fahey, Jens Mühle, Ray F. Weiss, James B. Burkholder: Experimental and Theoretical Study of the Atmospheric Chemistry and Global Warming Potential of SO2F2. In: The journal of physical chemistry A. 112, Nr. 49, März, S. 12657–12666. doi:10.1021/jp806368u.
- Hamburger Bürgerschaft, Schriftliche Kleine Anfrage, Begasung mit Sulfurylfluorid, Webseite der Hamburger Bürgerschaft, 10. Januar 2020, abgerufen am 1. April 2021.
- Deutschlands unbekannter Klimakiller, Der Spiegel, 31. März 2021, abgerufen am 1. April 2021.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 592.
- E. L. Muetterties: Sulfuryl fluoride. In: Eugene G. Rochow (Hrsg.): Inorganic Syntheses. Band 6. McGraw-Hill Book Company, Inc., 1960, S. 158–161 (englisch).
- F. Seel: Sulfuryl chloride fluoride and sulfuryl fluoride. In: S. Young Tyree, Jr. (Hrsg.): Inorganic Syntheses. Band 9. McGraw-Hill Book Company, Inc., 1967, S. 111–113 (englisch).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 590.
- Michael Doherty: HED Records Center Series 361 Science Reviews. Hrsg.: United States Environmental Protection Agency. 2004, S. 2.



