Staudinger-Keten-Cycloaddition
Die Staudinger-Keten-Cycloaddition (auch bekannt als Staudinger-Synthese) ist eine Namensreaktion der organischen Chemie, über die der deutsche Chemiker Hermann Staudinger 1907 erstmals berichtete. Durch diese Reaktion lassen sich β-Lactame herstellen. Sie ist nicht zu verwechseln mit der Staudinger-Reaktion, bei der es um die Reduktion von Aziden zu Aminen geht.[1]
Übersichtsreaktion
Bei der Staudinger-Synthese reagieren unter [2+2]-Cycloaddition ein Imin und ein Keten zu einem β-Lactam:
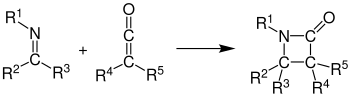
Allgemein
Bei der Staudinger-Keten-Cycloaddition handelt es sich um eine Synthese, der bis heute viel Aufmerksamkeit zuteilwird. Zur Stereochemie dieser Reaktion werden noch immer Abhandlungen verfasst. Als Lösungsmittel wurde ursprünglich für das Imin Diethylether und für das Keten Petrolether genutzt. Durch Erwärmen fällt das Produkt aus, welches nach einigen Stunden abfiltriert und gewaschen werden kann.[1]
Reaktionsmechanismus
Der Reaktionsmechanismus der Staudinger-Synthese könnte wie folgt aussehen.[2] Im ersten Schritt greift das freie Elektronenpaar des Stickstoffs des Imins 1 nucleophil am zentralen Kohlenstoffatom der Ketengruppe der Verbindung 2 an. Es entsteht das Zwitterion 3. Durch einen intramolekularen nucleophilen Angriff am Kohlenstoff der Imingruppe kommt es zum Ringschluss. Es entsteht das β-Lactam 4:

Stereochemie
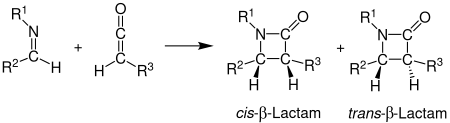
Das Verstehen der Stereoselektivität bei der Bildung von β-Lactamen mit Hilfe der Staudinger-Synthese ist immer noch ein nicht vollständig gelöstes Problem. Es wird jedoch davon ausgegangen, dass die Richtung aus der das Imin angreift und die Isomerisierung die Stereoselektivität bestimmen. Außerdem wurde beobachtet, dass Ketene mit starken Elektronendonatoren als Substituenten meistens für das Entstehen eines cis-Produkts sorgen und Ketene mit starken Elektronenakzeptor als Substituenten die Herstellung von dem trans-Produkt begünstigen. Es wurden viele Theorien zur Stereochemie der Staudinger-Synthese entwickelt, aber es konnte noch keiner eine allgemeine Gültigkeit zugeschrieben werden. Bei der [2+2]-Cycloaddition von einem Imin und einem Keten können das cis- und das trans-Produkt entstehen.[2]
Variationen
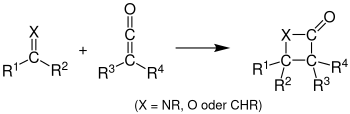
Bei der Thio-Staudinger-Cycloaddition reagiert ein Thioketen anstelle des Oxoketens.[3] Bei der Reaktion von einem Keten mit einem Alken entsteht ein Cyclobutanon, mit einer Carbonylverbindung entsteht ein β-Lacton und mit einem Carbodiimid kann ein 4-Imino-β-lactam hergestellt werden.[4] Es muss beachtet werden, dass instabile Staudinger-Produkte zu Folgeprodukten weiterreagieren können.
Eintopfreaktion
Eine Eintopfreaktion gemäß der Staudinger-Synthese wurde 2014 von dem Team um Doyle beschrieben. Bei dieser Synthese reagieren ein Azid und zwei Diazoverbindungen mit Rhodium(II)-acetat als Katalysator und mit Dichlormethan als Lösungsmittel zu einem β-Lactam. Die Reaktion findet über 3 Stunden bei Raumtemperatur statt und liefert eine Ausbeute von ca. 99 %.[5]
Sulfa-Staudinger-Cycloaddition
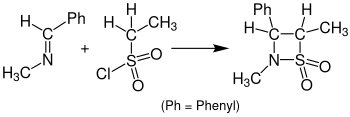
Die Reaktion mit Sulfenen statt Ketenen, die zur Bildung von β-Sultamen führt, wird Sulfa-Staudinger-Cycloaddition genannt.[6] Lösungsmittel und Reaktionstemperatur können einen erheblichen Einfluss auf die Ausbeuten haben. Bewährt hat sich die Durchführung in Dichlormethan mit einem Zusatz von Triethylamin bei 20 °C. Die Temperatur sollte während der eigentlichen Addition nicht zu niedrig angesetzt werden.[7] Gelegentlich wird Tetrahydrofuran als Lösungsmittel verwendet.[6] Die folgende Abbildung zeigt die Reaktion von Benzyliden(methyl)amin mit Ethansulfonsäurechlorid zu dem entsprechenden β-Sultam.
Anwendung
Knapp 40 Jahre nach der Veröffentlichung der Staudinger-Keten-Cycloaddition wurde dieser erst breitere Beachtung geschenkt. Zu dieser Zeit wurde festgestellt, dass Penicillin β-Lactame enthält. Des Weiteren begann mit Staudingers Bericht die Erforschung der [2+2]-Cycloaddition noch 20 Jahre bevor die Diels-Alder-Reaktion veröffentlicht wurde. Die Staudinger-Synthese ist eine der fundamentalsten und eine der vielseitigsten Methoden zur Herstellung von β-Lactamen. Diese spielen sowohl für die pharmazeutische Chemie, als auch für die synthetische Chemie eine sehr wichtige Rolle.[2][8]
Einzelnachweise
- Hermann Staudinger: Zur Kenntnis der Ketene. Diphenylketen. In: Justus Liebigs Annalen der Chemie. Band 356, Nr. 1–2. John Wiley & Sons, Inc., 1907, S. 51–123, doi:10.1002/jlac.19073560106.
- Lei Jiao, Yong Liang, Jiaxi Xu: Origin of the Relative Stereoselectivity of the β-Lactam Formation in the Staudinger Reaction. In: Journal of the American Chemical Society. Band 128, Nr. 18, 2006, S. 6060–6069, doi:10.1021/ja056711k.
- Wei He u. a.: Sterically controlled diastereoselectivity in thio-Staudinger cycloadditions of alkyl/alkenyl/aryl-substituted thioketenes. In: Organic & Biomolecular Chemistry. 2017, S. 5541–5548, doi:10.1039/C7OB01214D.
- Jie Jack Li: Name reactions. A collection of detailed reaction mechanisms. 3. Auflage. Springer-Verlag, Berlin 2006, ISBN 978-3-540-30030-4, S. 561–562, doi:10.1007/3-540-30031-7.
- Michael D. Mandler, Phong M. Truong, Peter Y. Zavalij, Michael P. Doyle: Catalytic Conversion of Diazocarbonyl Compounds to Imines: Applications to the Synthesis of Tetrahydropyrimidines and β-Lactams. In: Organic Letters. Band 16, Nr. 3, 2014, S. 740–743, doi:10.1021/ol403427s.
- Zhanhui Yang, Ning Chen, Jiaxi Xu: Substituent-Controlled Annuloselectivity and Stereoselectivity in the Sulfa-Staudinger Cycloadditions. In: The Journal of Organic Chemistry. Band 80, Nr. 7, 2015, S. 3611–3620, doi:10.1021/acs.joc.5b00312.
- Q. Wu, Z. Yang, J. Xu: Temperature-dependent annuloselectivity and stereochemistry in the reactions of methanesulfonyl sulfene with imines. In: Organic & Biomolecular Chemistry. Nr. 30, 2016, S. 7258–7267, doi:10.1039/c6ob01259k.
- Thomas T. Tidwell: Hugo (Ugo) Schiff, Schiff Bases, and a Century of β‐Lactam Synthesis. In: Angewandte Chemie International Edition. Band 47, Nr. 6. John Wiley & Sons, Inc., 2008, S. 1016–1020, doi:10.1021/ja056711k.