Sonn-Müller-Reaktion
Die Sonn-Müller-Reaktion (auch als Sonn-Müller-Methode bekannt) ist eine Namensreaktion der Organischen Chemie, die 1919 erstmals beschrieben wurde und nach ihren Entdeckern Adolf Sonn (1867–1942) und Ernst Müller (1881–1945) benannt ist.
Übersichtsreaktion
Aromatische Anilide werden mit Phosphorpentachlorid, Zinn(II)-chlorid, verdünnter Salzsäure und Wasser zu aromatischen Aldehyden umgesetzt:
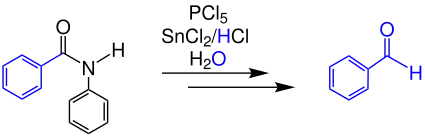
Reaktionsmechanismus
Im ersten Schritt findet eine Additionsreaktion des Phosphorpentachlorids an das Anilid 1 statt. Diese ergibt die Bildung des Intermediats 2. Anschließend wird das zentrale, positiv polarisierte Kohlenstoffatom vom Chloridanion angegriffen, wodurch Verbindung 3 entsteht. Durch Eliminierung eines Salzsäure- und Phosphoroxychloridmoleküls wird das Imidoylchlorid 4 gebildet:[1]
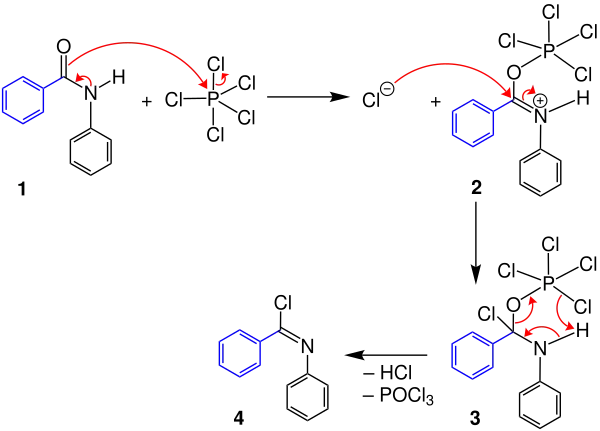
4 wird nun mit Zinn(II)-chlorid reduziert. Das Zinnkation überträgt ein Elektron auf das Chloratom. Ein weiteres Elektron aus der Bindung zwischen dem Kohlenstoff- und Chloratom wird dem Chloratom zugeordnet. Das entstandene Chloridanion koordiniert an das formal positiv geladene Zinnkation, sodass das Radikal 5 und Zinn(III)-chlorid entsteht. Ein weiterer Elektronenübergang vom Zinnkation auf das Radikal bewirkt die Bildung des Carbanions 6.
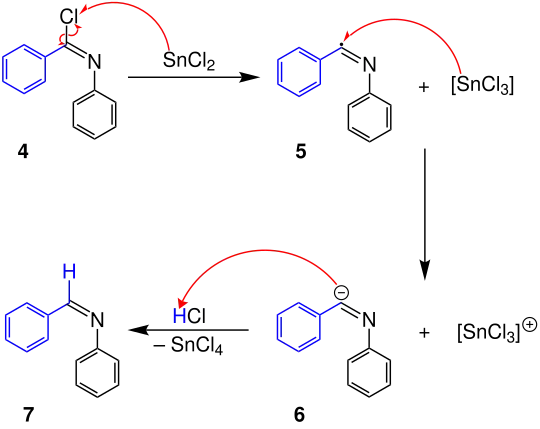
Das Carbanion 6 wird mittels verdünnter Salzsäure protoniert. Das dabei entstehende Chloridanion koordiniert an das Zinnsalz. Zinn(IV)-chlorid entsteht als Abfallprodukt. Das entstandene Imin 7 wird nun über Struktur 8 hydrolytisch gespalten.[2]
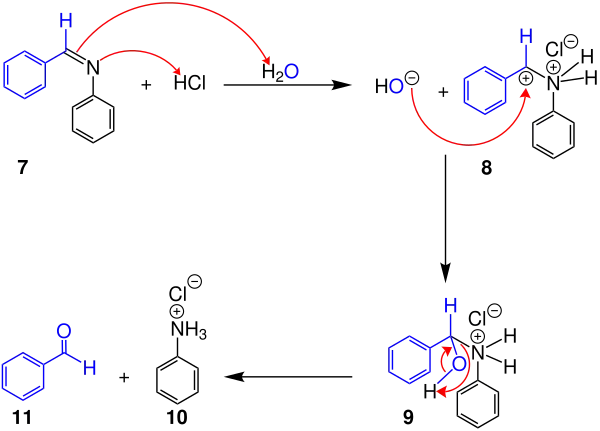
Im gewählten Beispiel entsteht, neben dem Anilinsalz 10, Benzaldehyd 11 als Hauptprodukt. Durch die Auswahl anderer Arylreste können andere aromatische Aldehyde gewonnen werden.
Praktische Bedeutung
Aufgrund der vielen Synthesemöglichkeiten von Carbonylverbindungen erlangte die Sonn-Müller-Reaktion keine größere präparative Bedeutung. Dennoch wurde sie im Verlauf der Geschichte immer wieder angewendet.[3][4] Gegenüber der Reduktion von Carbonsäurechloriden ist sie nur vom Vorteil, wenn das Anilid leicht zugänglich ist. Kurz nach Entdeckung der Reaktion waren Anilide durch die Friedel-Crafts-Acylierung von Isocyanaten mit Aromaten leichter zugänglich, weshalb die Synthese bestimmter aromatischer Aldehyde günstiger wurde.[5] Diese waren häufig auf geruchschemischem Gebiet von Bedeutung.[6] Aus medizinischer Sicht ist der Beitrag der Reaktion zur Synthese von Anästhetika zu erwähnen.[7]
Literatur
- Z. Wang: Comprehensive Organic Name Reactions and Reagents, Vol 2. John Wiley & Sons, Hoboken, New Jersey 2009, S. 2625–2627, ISBN 978-0-471-70450-8.
- A. Ingendoh, J. Falbe (Hrsg.): Methoden der organischen Chemie: Aldehyde. Erweiterungs- und Folgebände, Vol 4. Georg Thieme Verlag, Stuttgart, New York 1983, S. 473, ISBN 3-13-217304-5.
Einzelnachweise
- F. Effenberger, R. Gleiter: Synthese substituierter Benzoesäuren, Benzonitrile und Benzaldehyde, Chemische Berichte 1964, 97, S. 480–482, doi:10.1002/cber.19640970223.
- A. Sonn, E. Müller: Über eine neue Methode zur Umwandlung von Carbonsäuren in Aldehyde, Berichte der deutschen chemischen Gesellschaft 1919, 52, S. 1927–1934, doi:10.1002/cber.19190521002.
- P.E. Papadakis, W. Boand: Synthesis of 5-(2',3',4'-Trimethoxyphenyl)-4,6-dicarbethoxycyclohexanedione-1,3 and Derivatives, Journal of Organic Chemistry 1960, S. 2075–2077, doi:10.1021/jo01065a096.
- T. S. Work: 80. The synthesis of amines from amides through the amidodichlorides, Journal of the Chemical Society 1942, S. 429–432, doi:10.1039/JR9420000429.
- L. F. Fieser, L. M. Joshel: 5-Methylchrysene, Journal of the American Chemical Society 1940, S. 1211–1214, doi:10.1021/ja01862a064.
- J. v. Braun, W. Rudolph: Amid‐ und Imidchloride nicht‐aromatischer Säuren, VIII. Mitteil.: Darstellung α,β‐ungesättigter Aldehyde, Berichte der deutschen chemischen Gesellschaft 1934, 67, S. 269–281, doi:10.1002/cber.19340670223.
- R. C. Roberts, T. B. Johnson: The preparation of derivatives of diphenic acid possessing the properties of local anesthetics, Journal of the American Chemical Society 1925, S. 1396–1402, doi:10.1021/ja01682a026.